Organiske forbindelser

- 4080
- 1136
- Jonathan Moe
Vi forklarer hva organiske forbindelser er, deres egenskaper, typene som er, forskjellene med de uorganiske forbindelsene og gir flere eksempler
 Organiske forbindelser kommer fra levende vesener
Organiske forbindelser kommer fra levende vesener Hva er organiske forbindelser?
De Organiske forbindelser De er de som kommer fra levende vesener og inneholder karbon- og hydrogenatomer knyttet til hverandre i form av åpne kjeder eller lukkede sykluser.
I tillegg til karbon og hydrogen, kan organiske forbindelser også inneholde andre elementer som oksygen (O), nitrogen (N), svovel (er), fosfor (P), fluor (F), klor (CL), brom (BR) eller jod (i). Alle disse kalles heteroátomos.
Livet ville ikke være mulig uten organiske forbindelser, så alle levende vesener inneholder dem. Det er tusenvis av disse stoffene, og vi kan finne dem overalt, og starter med våre egne kropper.
Kjennetegn på organiske forbindelser
De er basert på karbonkjemi
Karbon danner grunnlaget for alle organiske forbindelser. I disse forbindelsene kan karbonatomer knyttes til hverandre eller med andre elementer. Hvert karbonatom danner alltid 4 bindinger totalt, mellom enkle, doble og trippelbindinger.
De har kovalente lenker
Det er tre typer viktigste kjemiske koblinger som er den kovalente, ioniske og metalliske bindingen. Organiske forbindelser er preget av å ha bare kovalente bindinger blant alle atomene deres.
De er drivstoff
 Karbon er et drivstoff som er oppnådd fra de organiske forbindelsene som er til stede i treverket
Karbon er et drivstoff som er oppnådd fra de organiske forbindelsene som er til stede i treverket Ved å inneholde så mange karbonatomer, er organiske forbindelser brennbare. Dette betyr at de kan brenne ved hjelp av en forbrenningsreaksjon med oksygenet i luften.
Forbrenningsreaksjonene til organiske forbindelser er eksotermiske reaksjoner som frigjør veldig varme. Alle levende vesener utnytter all denne energien for å utføre alle reaksjonene som holder oss i live.
De har isomeria
Mange organiske forbindelser har den samme molekylære formelen, men de er helt forskjellige forbindelser. Denne egenskapen kalles Isomeía, og er karakteristisk for organiske forbindelser.
For eksempel har både den metiliske etanoletanol den molekylære formelen C2H6Eller, men den første er en gass mens den andre er en væske.
De kan danne polymerer
Et annet kjennetegn ved organiske forbindelser er at de kan danne gigantiske molekyler som gjentar en gruppe atomer igjen og igjen i en lang kjede. Disse forbindelsene kalles polymerer og et typisk eksempel på dem er plast.
Løselighet
En annen eiendom som kjennetegner organiske forbindelser er deres løselighet. Mange av dem, særlig polare organiske forbindelser, er oppløselige i vann. Andre forbindelser oppløses ikke i vann, men i organiske løsningsmidler som cyclohexan.
Kan tjene deg: Succinic Acid: Struktur, egenskaper, innhenting, brukTyper organiske forbindelser
Organiske forbindelser har egenskaper og egenskaper som gjør dem veldig forskjellige fra uorganiske forbindelser (de som ikke kommer fra levende vesener, for eksempel mineraler).
Mange av disse egenskapene lar dem klassifisere dem på forskjellige måter, noe som gir opphav til forskjellige typer organiske forbindelser. De viktigste klassifiseringskriteriene er:
- I henhold til opprinnelsen.
- I henhold til dens struktur og komposisjon.
- I følge den funksjonelle gruppen.
- I følge hans polaritet.
Deretter er typene organiske forbindelser klassifisert i henhold til hvert av disse kriteriene beskrevet:
Typer organiske forbindelser i henhold til deres opprinnelse
Hvis de kommer fra, kan organiske forbindelser være:
- Naturlige organiske forbindelser: De er de som er funnet i naturen, og som kommer direkte fra levende vesener. Cellulose er et godt eksempel, siden det er den mest tallrike naturlige organiske forbindelsen på jorden.
- Syntetiske organiske forbindelser: De refererer til de organiske forbindelsene som er syntetisert av kjemikalier i et laboratorium eller i et kjemisk anlegg. All plast vi bruker daglig er syntetisk, og også mange medisiner.
Typer organiske forbindelser i henhold til deres struktur og sammensetning
I henhold til atomene som omfatter dem og måten disse atomene er forent sammen, kan organiske forbindelser være:
- Alifatiske hydrokarboner: dannet bare av karbon og hydrogen og der karbonatomer danner åpne kjeder enten lineære eller forgrenede. De inkluderer Alquenos og Alkines.
- Aromatiske hydrokarboner: Forbindelsene som tilhører denne familien, også kalt sand, inneholder umettede sykluser (som fremdeles kan ha mer hydrogen) som har stor molekylær stabilitet. Denne egenskapen kalles aromatisk og er karakteristisk for benzen og alle dens derivater.
- Heterocykliske forbindelser: De er sykliske forbindelser der ett eller flere karbonatomer erstattes av en heteroátomo som kan være oksygen, nitrogen, svovel eller fosfor. Eksempler på heterocykler er pyridin og furano.
- Organometalliske forbindelser: De er en spesiell klasse av forbindelser som er halvveis mellom å være organiske og uorganiske. De er preget av å inneholde en organisk del med et heteroátom.
Typer organiske forbindelser i henhold til den funksjonelle gruppen
Den delen av et organisk molekyl der kjemiske reaksjoner vanligvis forekommer er en liten gruppe atomer som kalles en funksjonell gruppe. Det er flere forskjellige funksjonelle grupper som tillater klassifisering av organiske forbindelser i:
- Stenger: De inneholder bare karbon og hydrogen koblet bare ved enkle bindinger. For eksempel butan.
- Alkenes: De er hydrokarboner som inneholder et dobbelt karbon-karbonbinding. For eksempel buuten.
- Alkynes: De er hydrokarboner som inneholder en trippel karbon-karbonbinding. For eksempel etino, også kjent som acetylen.
- Alkyl Halogenuros: Organiske forbindelser som inneholder et halogen (F, CL, BR eller I) knyttet til et alifatisk karbon. For eksempel klormetan.
- Alkoholer: Alkohol er polare organiske forbindelser som inneholder en hydroksylgruppe (-OH) sammen med et alifatisk karbon.
- Fenoler: Disse forbindelsene inneholder også en hydroksylgruppe (-OH), men i dette tilfellet sammen med et aromatisk karbon.
- Ethers: De gjenkjennes lett, siden de er to karbonommer kjeder sammen med hverandre av et oksygenatom. For eksempel metyleteren.
- Aminer: De er organiske forbindelser avledet fra ammoniakk (NH3). De inneholder en eller flere alifatiske karbonatomer (alkylgrupper) knyttet til et nitrogenatom ved hjelp av enkle bindinger.
- Aldehyder: Oksygenerte organiske forbindelser som inneholder en karbonylgruppe (C = O) sammen med et hydrogen i en av dens terminale karbonatomer. Generelt har de karakteristisk lukt, for eksempel cinamaldehyd som gir lukten av kanel.
- Ketoner: De er oksygenerte organiske forbindelser som inneholder en karbonylgruppe (C = O) sammen med to karbonkjeder.
- Karboksylsyrer: Også kalt organiske syrer, de er svake syrer som inneholder en karboksylgruppe (-COOH) i en av dens terminale karbonatomer.
- Estere: De kommer fra foreningen av en karboksylsyre med alkohol. I dette tilfellet erstattes hydrogenet til karboksylgruppen av en leiegruppe.
- Amidas: De kommer fra foreningen av en karboksylsyre med amin. I dette tilfellet erstattes OH for karboksylgruppen av et nitrogen festet til to hydrogener, et hydrogen og en alkyl eller to alkaler.
Typer organiske forbindelser i henhold til deres polaritet
Vi kan også klassifisere organiske forbindelser i polar og apolar:
- Polare organiske forbindelser: Disse forbindelsene har polare kovalente bindinger med atomer som nitrogen og oksygen som gjør hele molekylet polar. De fleste av disse forbindelsene er oppløselige i vann.
- Apolare organiske forbindelser: De er de som ikke har polare lenker eller polaritetene i koblingene deres blir kansellert med hverandre. Disse forbindelsene er ikke oppløselige i vann.
Forskjeller mellom organiske forbindelser og uorganiske forbindelser
Følgende tabell oppsummerer forskjellene mellom organiske og uorganiske forbindelser:
Organiske forbindelser | Uorganiske forbindelser | |
Opprinnelse: | Kommer fra levende vesener eller deres rester. | De kommer ikke fra levende vesener. |
Sammensetning: | Dannet nesten utelukkende av C, N, O, S, P, F, CL, BR og I. | De kan dannes av et hvilket som helst element i det periodiske bordet. |
Typer lenker: | De danner kovalente bindinger både polar og apolar. | De kan danne alle typer kjemiske koblinger, inkludert polare, apolare, ioniske eller metalliske kovalente bindinger. |
Isomery: | De fleste tilstede Isomeía. | Bare noen tilstedeværende Isomeía. |
Drivstoff: | De er drivstoff. | De fleste er ikke brennbare. |
Eksempler på organiske forbindelser
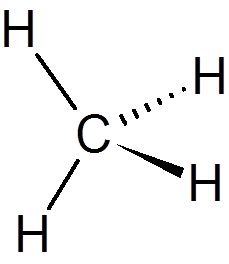
1. Metan (kap4)
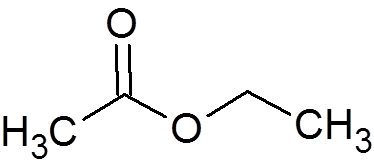
2. Etylacetat (C4H8ENTEN2)
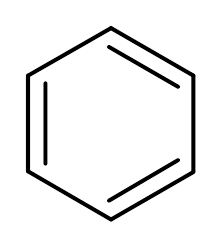
3. Benzen (ca6H6)
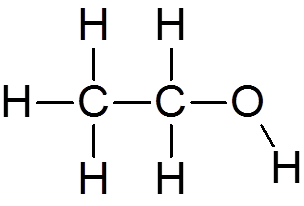
4. Etylalkohol (C2H6ENTEN)
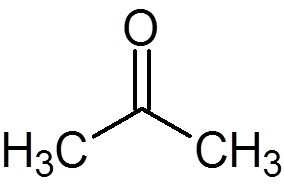
5. Aceton (c3H6ENTEN)
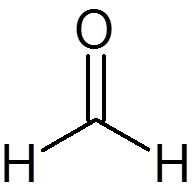
6. Formaldehyd (kap2ENTEN)
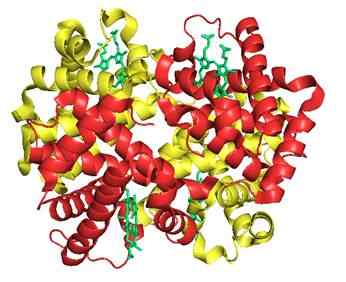
7. Hemoglobin (et protein)
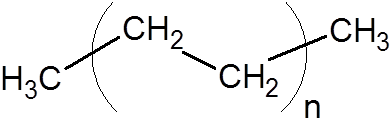
8. Polyetylen (en av de vanligste plastene)
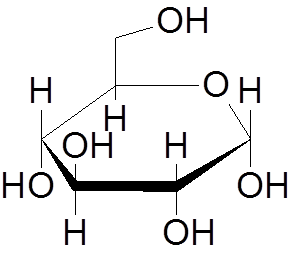
9. Glukose (c6H12ENTEN6)
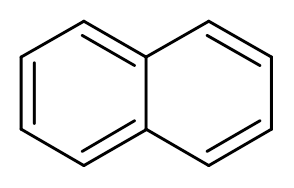
10. Naftalen (ca10H8)
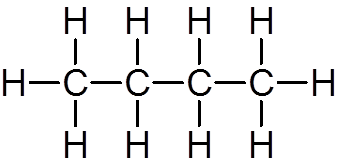
elleve. Butano (c4H10)
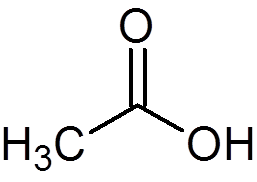
12. Eddiksyre eller eddik (C2H4ENTEN2)
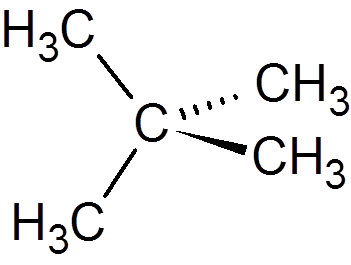
1. 3. Neopentano (ca5H12)
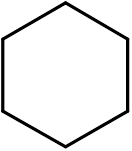
14. Cyclohexan (ca6H12)
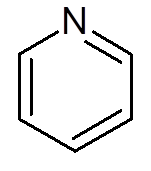
femten. Pyridin (c5H5N)
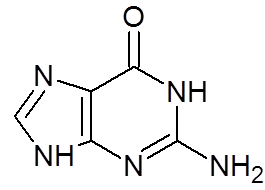
16. Guanina (c5H5N5ENTEN)
17. Fruktose (c6H12ENTEN6)
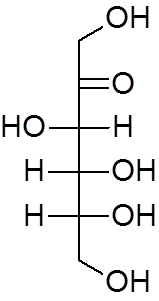
18. Etyleter (C4H10ENTEN)
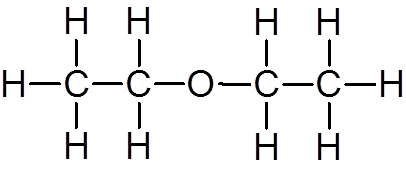
19. Metanol (kap4ENTEN)
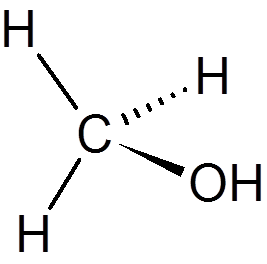
tjue. Kloroform (Chcl3)
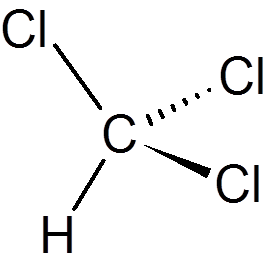
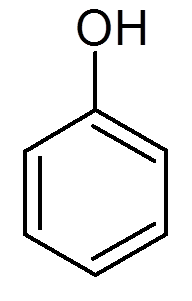
tjueen. Fenol (c6H6ENTEN)
22. Acetylen (ca2H2)
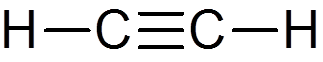
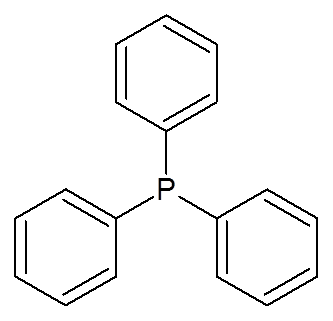
23. Trifenylfosfin ((C6H6)3P)
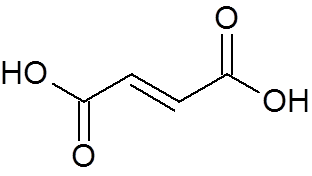
24. Trans-Buteodioic Acid (C4H4ENTEN4)
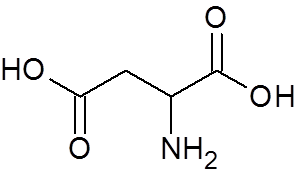
25. Asparaginsyre (en aminosyre) (C4H7NEI4)
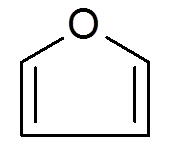
26. Furano (c4H4ENTEN)
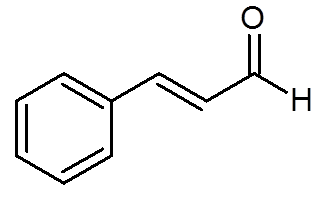
27. Cinamaldehyd (Aroma of Cinnamon) (C9H8ENTEN)
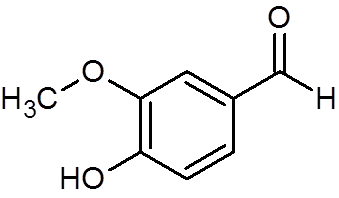
28. Vaniline (c8H8ENTEN3)
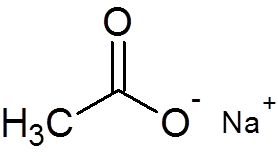
29. Natriumacetat (C2H3ENTEN2Na)
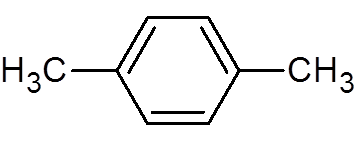
30. P-xylen (ca8H10)
Referanser
- Carey, f., & Giuliano, r. (2013). Organic Chemistry, 9. utgave (9. utg.). New York City, New York: McGraw-Hill Education.
- Slott a., M. G. (s.F.). Hovedklasser av organiske forbindelser og funksjonelle grupper. Gjenopprettet fra UAEH.Edu.MX
- Chang, R., & Goldsby, K. TIL. (2012). Kjemi, 11. utgave (11. utg.). New York City, New York: McGraw-Hill Education.
- Klein, d. R. (2011). Organisk kjemi (1.til Ed.). Hoboken, New Jersey: Wiley.
- Morrison, r. T., & Boyd, r. N. (2003). Organisk kjemi (6. utg.). Boston, Massachusets: Allyn & Bacon.

