Kernel elektronisk konfigurasjonskonstruksjon, eksempler
- 1845
- 397
- Marius Aasen
De Kernel elektronisk konfigurasjon eller kompakt er at hvis kvantumnotasjoner av antall elektroner og deres energi -underutstyr er forkortet av symbolene på edle gasser i firkantede parenteser. Det er veldig nyttig når du skriver elektroniske konfigurasjoner for et bestemt element, da det er enkelt og raskt.
Ordet 'kjerne' refererer vanligvis til de elektroniske indre lagene i et atom; Det vil si at de som deres elektroner ikke er fra Valencia og derfor ikke deltar i den kjemiske bindingen, selv om de definerer elementets egenskaper. Metaforisk sett ville kjernen være det indre av løken, med lagene sammensatt av en serie voksende orbitaler i energi.
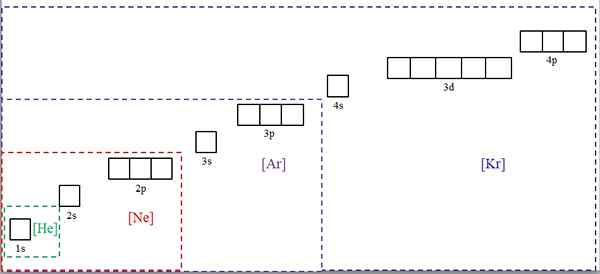
 Elektroniske konfigurasjoner forkortet med symbolene på edle gasser. Kilde: Gabriel Bolívar.
Elektroniske konfigurasjoner forkortet med symbolene på edle gasser. Kilde: Gabriel Bolívar. Det overordnede bildet viser kjemiske symboler for fire av edelgassene i firkantede parenteser og med forskjellige farger: [He] (grønn), [ne] (rød), [AR] (lilla) og [KR] (blå) (blå).
Hver av de stiplede rammene inneholder bokser som representerer orbitalene. Jo større, jo større antall elektroner som inneholder; som igjen vil bety at de elektroniske konfigurasjonene av flere elementer kan forenkles med disse symbolene. Dette sparer tid og energi ved å skrive alle notasjoner.
[TOC]
Konstruksjonsordre
Før du bruker elektroniske konfigurasjoner av kjerner, er det praktisk å gjennomgå riktig rekkefølge for å bygge eller skrive disse konfigurasjonene. Dette styres i henhold til diagonalregelen eller Moeller -diagrammet (kalt inn noen deler av regnet). Når du har dette diagrammet for hånden, forblir kvantemeldinger som følger:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Kan tjene deg: Grunnleggende salter: Formel, egenskaper, nomenklatur, eksemplerDenne raden med kvantetoner ser utmattet ut; Og det ville være enda mer hvis du måtte skrive det alle tider for å bli representert den elektroniske konfigurasjonen av ethvert element som ble funnet i perioden 5 og utover. Merk at raden er tom for elektroner; Det er ingen tall med høyere rettigheter (1s22s22 s6...).
Det må huskes at orbitaler s kan "være vertskap for" to elektroner (ns2). Orbitalene p Det er tre totalt (se på de tre boksene ovenfor), slik at de kan være vertskap for seks elektroner (NP6). Og til slutt orbitalene d Det er fem, og F syv, med totalt ti (ND10) og fjorten (NF14) elektroner, henholdsvis.
Elektronisk konfigurasjonsforkortelse
Når det er sagt, er den fremre raden med kvantemonteringer fylt med elektroner:
1s2 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 s6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Hvor mange elektroner er totalt? 118. Og hvilket element tilsvarer en så massiv mengde elektroner i atomet? Til edel oganisk gass, OG.
Anta at det er et element med et kvantetall Z lik 119. Deretter ville den elektroniske konfigurasjonen av Valencia være 8s1; Men hva ville være den komplette elektroniske konfigurasjonen?
1s2 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 s6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6 8s1
Og hva som ville være din elektroniske kjerneelektroniske konfigurasjon, kompakte? Dette:
[OG] 8s1
Legg merke til den åpenbare forenklingen eller forkortelsen. I symbolet [OG] telles alle de 118 elektronene som er skrevet ovenfor, så dette usikre elementet har 119 elektroner, hvorav bare en er fra Valencia (det vil være plassert under Francio i det periodiske tabellen).
Kan tjene deg: Hva er en mettet løsning? (Med eksempler)Eksempler
Generell
Anta at du nå vil utføre forkortelsen gradvis:
[Han] 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 s6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Merk at 1s2 Det ble erstattet av [han]. Den neste edle gassen er neonen, som har 10 elektroner. Når vi vet dette, fortsetter forkortelsen:
[NE] 3S2 3p6 4s2 3d10 4p6 5s2 4d10 5 s6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Følg deretter argonen, med 18 elektroner:
[AR] 4S2 3d10 4p6 5s2 4d10 5 s6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Fordi den neste edelgassen er Kripton, er ytterligere 36 elektroner avansert:
[Kr] 5s2 4d10 5 s6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Xenon har 54 elektroner, og derfor flytter vi forkortelsen til 5p orbital:
[Xe] 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
På dette tidspunktet er den elektroniske konfigurasjonen alltid forkortet til NP -orbitalen; Det vil si at edle gasser har disse orbitaler fulle av elektroner. Og til slutt følg radonen, med 86 elektroner, så vi forkortes til 6p orbital:
[RN] 7s2 5f14 6d10 7p6
Oksygen
Oksygen har åtte elektroner, og er dens komplette elektroniske konfigurasjon:
1s22s22 s4
Den eneste forkortelsen vi kan bruke er [han] av 1s2. Dermed er dens elektroniske konfigurasjon av kjernen:
[Han] 2s22 s4
Kalium
Kalium har nitten elektroner, og er dens komplette elektroniske konfigurasjon:
Kan tjene deg: hvor kommer plast fra? Historie og typer1s2 2s2 2 s6 3s2 3p6 4s1
Merk at vi kan bruke symbolet [HE] for å forkorte den konfigurasjonen; så vel som [ne] og [ar]. Det siste er det som brukes fordi Argon er den edle gassen som går foran den nærmeste kalium. Derfor gjenstår dens elektroniske konfigurasjon av kjernen:
[AR] 4S1
Indianer
Indianeren har førti -nine elektroner, og er dens komplette elektroniske konfigurasjon:
1s2 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 s1
Siden Kripton er den nærmeste edle gassen som går foran indianeren, brukes [KR] -symbolet for forkortelse, og dens elektroniske konfigurasjon av kjernen er:
[Kr] 5s2 4d10 5 s1
Selv om 4D -orbitaler ikke formelt tilhører den indiske kjernen, griper ikke deres elektron.
Wolfram
Tungsten (eller Wolframio) har 74 elektroner og dens komplette elektroniske konfigurasjon er:
1s2 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 s6 6s2 4f14 5 d4
Igjen ser vi etter den nærmeste edle gassen. I hans tilfelle tilsvarer det Xenón, som har sine 5p orbitaler fullført. Dermed erstatter vi raden med kvantemeldinger med symbolet [XE], og vi vil endelig ha dens elektroniske konfigurasjon av kjernen:
[Xe] 6s2 4f14 5 d4
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Pat Thayer. (2016). Elektronkonfigurasjonsdiagrammer. Gjenopprettet fra: ChemistryApp.org
- Helmestine, Anne Marie, PH.D. (5. desember 2018). Noble Gas Core Definisjon. Gjenopprettet fra: Thoughtco.com/
- Wikipedia. (2019). Elektronisk konfigurasjon. Gjenopprettet fra: er.Wikipedia.org
- « Uran Disco historie og sangere som har vunnet den
- Tuskegee eksperimenthistorie, motiver og kritikk »

