Hastighetskonstant

- 697
- 162
- Marius Aasen
Hva er hastighetskonstanten?
De hastighetskonstant Det er en konstant av proporsjonaliteten av hastighetsloven for kjemisk kinetikk, som etablerer en sammenheng mellom den molære konsentrasjonen av reagensene og hastigheten på reaksjonen.
Som reagensene bruker reaksjonshastighetene også, reduseres også. Det er grunnen til at i beregningene av hastighetskonstanten, representert med 'K' -symbolet, tas de første hastighetene i betraktning, for å ha et sammenligningspunkt mellom flere eksperimenter.

Den kjemiske kinetikken indikerer at denne konstanten avhenger av reaksjonsordrene til reagensene, hvis konsentrasjoner vil være å endre hastigheten på reaksjonen. På den annen side, i henhold til Arrhenius -ligningen, avhenger K også av temperaturen og aktiveringsenergien for reaksjonen.
Det er derfor det sies at hastighetskonstanten ikke er en ekte konstant, siden den varierer med temperaturen og også med tilstedeværelsen av katalysatorer som modifiserer aktiveringsenergien. Derfor er det ikke mange tabeller der de kommer for spesifikke reaksjoner (og forhold).
For eksempel, for en reaksjon der a og b reagerer, hver med en reaksjonsrekkefølge på 1, rapporterte konstanten K til 25 ° C, og med tilsetning av en viss mengde katalysator, vil den ikke være den samme hvis reaksjonen er laget til en temperatur på 26 eller 27 ºC. Den minste variasjon vil påvirke verdien av k, som bare er konstant under forholdene som er etablert for eksperimenter.
Hvordan beregne hastigheten konstant?
Eksperimentering
Bestemmelsen av verdien av hastighetskonstanten til en reaksjon blir gjort eksperimentelt. Hvis du for eksempel vil bestemme verdien av hastighetskonstanten for en reaksjon av formen:
A +B → C
For etablering av verdien av K kan tre reaksjoner gjøres, med følgende forskjeller: i reaksjon 2 er den opprinnelige konsentrasjonen av reagens A konstant, [A], men er doblet for eksempel konsentrasjonen av reagens B, [ B].
I mellomtiden blir i reaksjon 3 [a] doblet sammenlignet med reaksjon 1, og holder konstant [B].
Dermed vil det bygges en tabell med konsentrasjoner som vil tjene til å sammenligne de første hastighetene mellom flere eksperimenter. Dette med det formål å bestemme reaksjonsordrer, og fortløpende for å beregne hastighetskonstanten.
Kan tjene deg: Aluminiumhydroksyd: Struktur, egenskaper, bruksområder, risikoerReaksjonsordrer
Første beregning
For den forrige reaksjonen er hastigheten uttrykt ved ligningen:
Reaksjonshastighet = k · [a]x· [B]og
Hvor 'x' e 'og' tilsvarer henholdsvis reaksjonsordrene for reagenser A og B.
For å bestemme verdiene til reaksjonsordrene, må en sammenligning mellom reaksjon 2 og 1, samt mellom reaksjon 3 og 1 gjøres.
Når man sammenligner reaksjon 1 med de 2, kan det for eksempel observeres at ved å duplisere [b] er det en duplisering av reaksjonshastigheten.
Deretter: andelen [b] mellom reaksjonene 2 og 1 er 2, så vel som andelen mellom hastighetene på reaksjonene. Deretter kan ordreverdien på reaksjonen oppnås med hensyn til B (eksponent og), gjennom følgende tilnærming:
 Beregning av reaksjonsrekkefølgen 'og'. Kilde: Gabriel Bolívar.
Beregning av reaksjonsrekkefølgen 'og'. Kilde: Gabriel Bolívar. Hastigheten på eksperimentet 2 er to ganger raskere enn hastigheten på eksperimentet 1. Dermed vil vi dele de to ligningene ovenfor:
2 = 2og
Derfor 'og' Vale 1, å kunne konkludere med at reaksjonsrekkefølgen med hensyn til reagens B er av den første ordren.
Andre beregning
På samme måte som vi fortsetter med reagenset A for beregning av 'X':
 Beregning av reaksjonsrekkefølgen 'x'. Kilde: Gabriel Bolívar.
Beregning av reaksjonsrekkefølgen 'x'. Kilde: Gabriel Bolívar. Hastigheten på eksperimentet eller reaksjonen 3 er fire ganger høyere enn eksperimentet eller reaksjonen 1. Derfor:
4 = 2x
ENTEN
22 = 2x
Og verdien av x er 2, så reaksjonen er andre orden i forhold til reagenset til.
Endelig rydding
Deretter kan verdien av hastighetskonstanten basert på noen av reaksjonene etableres:
Reaksjonshastighet = k · [a]2· [B]
Nok til å introdusere eksperimentelle verdier og fjerne k:
K = reaksjonshastighet / ([a]2· [B])
Eksempler
Følgende eksempler fungerer som en introduksjon før øvelsene løses fra følgende avsnitt.
Eksempel 1
I en kjemisk reaksjon:
a) Hvis den innledende konsentrasjonen av et reagens er doblet hastigheten på reaksjonen: hva er reaksjonsrekkefølgen med hensyn til dette reagenset?
b) Hvis økningen i reagenskonsentrasjon forårsaker en økning i hastigheten i en faktor på 8, hva som vil være reaksjonsrekkefølgen da?
c) Hvis konsentrasjonen av reagenset opplever en endring og hastigheten forblir den samme: hva er rekkefølgen på reaksjonen med hensyn til reagenset?
Det kan tjene deg: Cycopropane (C3H6)I a) Andelen reaksjonshastigheter er den samme, og andelen reagenskonsentrasjoner er lik 2x,
2 = 2x
Derfor er x = 1 og reaksjonsrekkefølgen med hensyn til reagenset 1.
I b) Andelen av reaksjonshastigheten er den samme 8 (23) og andelen av reagenskonsentrasjoner er lik 2x,
23 = 2x
Derfor er x = 3 og reaksjonsrekkefølgen med hensyn til reagenset 3-
Mens i C) reaksjonens hastighet er uavhengig av konsentrasjonen av reagenset, så reaksjonsrekkefølgen med hensyn til reagenset er null.
Eksempel 2
Reaksjonen:
2 nei2 + ENTEN2 → 2 nr2
Den har uttrykk for følgende hastighetslov:
Reaksjonshastighet = k · [nei2]2·ENTEN2.
Hva er den globale rekkefølgen på reaksjonen? Hvilke enheter ville k ha?
Reaksjonsrekkefølgen angående eller2 Det er 1, og reaksjonens rekkefølge med hensyn til ikke2 Det er 2, så den globale rekkefølgen på reaksjonen er summen av disse verdiene, det vil si 2 + 1 = 3.
Reaksjonens hastighet har M/S -enheter, og konsentrasjonene av reagensene er uttrykt i M. Lage en analyse av enhetene vi vil ha:
k = reaksjonshastighet / ([nei2]2·[ENTEN2]
= (M / s) / (m3)
= s-1M-2
Løste øvelser
Oppgave 1
Dataene om følgende reaksjon ble oppnådd ved 25 ° C:
A +2 B → C +2 D
Hva er uttrykket av hastighetsloven for denne reaksjonen? Hva er verdien av hastigheten din konstant?
Beregninger av reaksjonsordrer
Eksperimentelle data er:
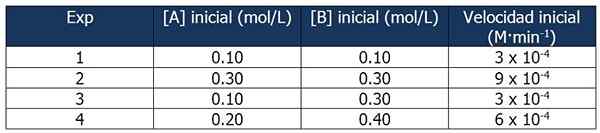 Cinetic Data of Exercise 1. Kilde: Gabriel Bolívar.
Cinetic Data of Exercise 1. Kilde: Gabriel Bolívar. Sammenligningen av eksperiment 1 og 3 lar deg trekke følgende konklusjoner:
Andel mellom hastighetene på reaksjonene 3 og 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Men andelen mellom B -konsentrasjoner er:
(0.3 mol / l) / (0.1 mol/l) = 3
Hastigheten på reaksjonen er uavhengig av konsentrasjonen av B, siden økningen ikke påvirker den. Derfor er reaksjonsrekkefølgen med hensyn til reagens B null.
På den annen side tillater sammenligningen av reaksjoner 4 og 1 følgende konklusjoner:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
I mellomtiden er andelen mellom [a] av reaksjoner 4 og 1 lik:
Kan tjene deg: 5 egenskaper ved homogene blandinger(0.20 mol / l) / (0.10 mol/l) = 2x
Da vil forholdet mellom proporsjonene være:
2 = 2x
x = 1
Derfor er uttrykket av hastighetsloven:
Reaksjonshastighet = k · [a]
B blir ikke tatt inn fordi reaksjonsrekkefølgen er null.
Beregning av k
Vi kan beregne hastighetskonstanten fra noen av de kinetiske dataene. La oss bruke eksperiment 1:
K = reaksjonshastighet / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 eller 0.003 min-1
Oppgave 2
Reaksjonshastighetsdataene ble oppnådd ved en viss temperatur.
2 Clo2 (AC) +2 OH- (AC) → CLO3- (AC) +CLO2 (AC) +H2Eller (l)
Beregninger av reaksjonsordrer
Eksperimentelle data er:
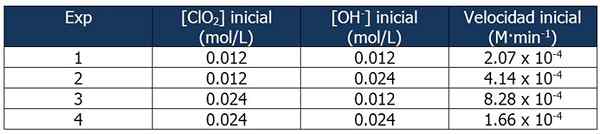 Cinetic Data om oppgave 2. Kilde: Gabriel Bolívar.
Cinetic Data om oppgave 2. Kilde: Gabriel Bolívar. Andelen mellom hastighetene til reaksjon 2 og reaksjon 1 er:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
Og andelen OH -konsentrasjoner- Mellom reaksjonene 2 og 1 er lik:
(0,024 mol/l)/(0,012 mol/l) = 2x
Eksponenten 'X' representerer reaksjonsrekkefølgen med hensyn til OH -reagensen-. Forholdet mellom beregnede proporsjoner kan bli representert som følger:
2 = 2x
x = 1
Derfor reaksjonsrekkefølgen med hensyn til OH -reagensen- er lik 1.
I reaksjon 3 er konsentrasjonen av CLO doblet2 av reaksjon 1, mens konsentrasjonen av OH- Forblir konstant.
Andel mellom hastighetene på reaksjonene 3 og 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
Og andelen [clo2] mellom reaksjonene 3 og 1 er lik:
(0,024 mol/l)/(0,012 mol/l) = 2og
Eksponenten 'og' representerer reaksjonsrekkefølgen angående CLO -reagens2.
Sammenligne proporsjonene:
22 = 2og
4 = 2og
y = 2
Derfor er reaksjonen nummer to med hensyn til CLO -reagensen2.
Uttrykket av hastighetsloven vil da være:
Reaksjonshastighet = k · [CLO2]2· [Åh-]
Beregning av k
Igjen kan vi beregne K fra forrige uttrykk ved å bruke noen av de kinetiske dataene for eksperimentene. Vi vil bruke eksperiment 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2020). Reaksjonshastighet konstant. Hentet fra: i.Wikipedia.org
- Kjemi Texas A&M University. (s.F.). Kinetikk: Beregninger av prøvehastighet. Gjenopprettet fra: Chem.tamu.Edu
- Keith J. Laidler. (2020). Reaksjonshastighet. Britannica Encyclopaedia. Gjenopprettet fra: Britannica.com
- Helmestine, Anne Marie, PH.D. (25. august 2020). Hva er hastighetskonstanten i kjemi? Gjenopprettet fra: Thoughtco.com
- Clark Jim. (2013). Rate Constants og Arrhenius -ligningen. Gjenopprettet fra: Chemguide.co.Storbritannia

