Coulombimetry grunnleggende, typer, applikasjoner

- 3733
- 544
- Thomas Karlsen
De Coulombimetry Det er en elektrokjemisk analyseteknikk som består i å utføre en uttømmende elektrolyse, slik at analytten kan kvantifiseres; det vil si for å bestemme konsentrasjonen av analytten i problemene problemer gjennom fullstendig oksidasjon eller reduksjon. Det er, i motsetning til potensiometri, en dynamisk teknikk, siden strømmen har lov til å strømme fritt gjennom elektrokjemiske celler.
Som navnet antyder, måles og korreleres den elektriske ladningen Q, i Coulomb -enheter, C, C, C, Coulomb Autes, C,. Derfor endrer oksidasjonstilstandene for analyttendringen, i prosessen en overføring og absorpsjon av elektronene som tillater den støkiometriske beregningen av ønsket konsentrasjon.
 Rudimentær montering for en elektrolyse der flere fargerike arter dannes på grunn av pH og kompleksdannelsen av skogbrukere som er til stede. Kilde: Steve Jurvetson fra Menlo Park, USA, CC av 2.0, via Wikimedia Commons
Rudimentær montering for en elektrolyse der flere fargerike arter dannes på grunn av pH og kompleksdannelsen av skogbrukere som er til stede. Kilde: Steve Jurvetson fra Menlo Park, USA, CC av 2.0, via Wikimedia Commons I Coulombimetry brukes et batteri eller potensiostat for å kontrollere strømmen eller potensialet som brukes på celler. Disse cellene, i motsetning til potensiometriske, består av et tre -elektrodesystem, og er utstyrt med et voltmeter og et ammeter.
Coulombimetry presenterer fordelen med å kunne utføre grader uten å forberede eller standardisere mønstre. Det tillater også å kvantifisere veldig små og begrensede mengder analyt, for eksempel metallkationer, uorganiske forbindelser og organiske forbindelser. For eksempel er det et coulometer designet utelukkende for å måle CO2 oppløst i prøver fra havet.
Denne teknikken tilbyr en annen analytisk rute enn volumetrisk og potensiometrisk, så mange analyser, avhengig av analytens elektrokjemiske natur, kan utvikle seg coulombimetrisk.
Teoretiske grunnlag av Coulombimetry
Faraday Law
Coulombimetry er basert på Faradays lov, som etablerer et forhold mellom den elektriske ladningen til en elektrokjemisk celle og mengden analyt som oksideres eller reduserer. Å vite denne belastningen Q, samt belastningen på et elektron (1.6 · 10-19 C), kan du beregne antall elektroner som er involvert i en reaksjon, nog-:
nog- = Q/e
På den annen side er det kjent at en mol elektroner (6.02 · 1023) Porta En elektrisk ladning lik 96485 C, en figur kjent som Faraday Constant:
F = inTIL
= 96485.3365 c/mol
Å være praktisk å uttrykke mengden elektroner avhengig av mol. Takket være dette kan de støkiometriske koeffisientene til en elektrokjemisk reaksjon brukes, være oksidasjon eller reduksjon, under hensyntagen til hvor mange mol elektroner som vinner eller mister arten.
Kan tjene deg: natriumfosfat: struktur, egenskaper, syntese, brukGrunnleggende beregninger
Tenk for eksempel følgende kjemiske ligning:
OX + 2E- → Nettverk
Når vi måler at når hele oksearten er redusert til et nettverk, kan vi beregne mol OX ved hjelp av konverteringsfaktorer:
xq · (mol e- /96485.3365 c) · (mol okse/ 2mol e-) = mol okse
Det vil si at som vi kjenner den elektriske ladningen for en mol med elektroner, vil vi ha hvor mange elektroner som tilsvarer belastningen XQ. Men på sin side brukes hver 2. mol av disse elektronene til å oksidere 1 mol okse.
Denne begrunnelsen forårsaker en direkte formel, selv om den ikke anbefales å huske den, men å kunne utlede den slik det var gjort:
n = Q/(fñog-)
Hvor ñog- Det er antall mol elektroner i den kjemiske ligningen.
Forutsatt at det kan beregnes Q, uavhengig av typen coulombimetri, kan molene til oksen eller nettverksanalytten bestemmes; Så lenge effektiviteten til strømmen er 100%. Det siste betyr at all belastningen som bare må være et produkt av en transformasjon, uten at andre arter er redusert eller oksidert.
Eksperimentelle grunnlag av coulombimetri
Celler
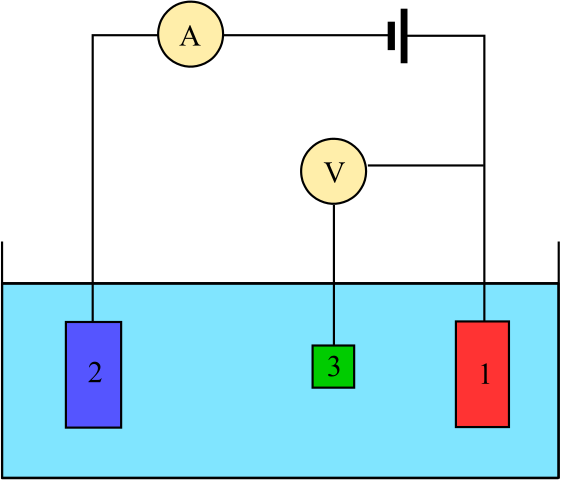 Diagram for en elektrokjemisk celle sammensatt av tre elektroder: referansen (3), assistenten (2) og arbeidet (1). Kilde: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagram for en elektrokjemisk celle sammensatt av tre elektroder: referansen (3), assistenten (2) og arbeidet (1). Kilde: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons UP har vi et diagram for en celle med tre elektroder, som ofte brukes i coulombimetriske analyser. Redoksreaksjonen finner sted blant arbeidselektroder (1) og hjelpe (2). Blant dem er to koblet til batteriet, for å bruke potensialene på cellen, og ammeteret (a), for å måle de elektriske strømningene.
Imidlertid er det nødvendig. På denne måten kan potensialet til hele cellen bestemmes, ogcelle, nødvendig for å estimere slutten av redoksreaksjonene i en av typer coulombimetri.
Legg merke til at mellom arbeidselektroden og referanseelektroden nesten ikke flyter strøm på grunn av den høye impedansvoltmeteret (V), takket være at det er en avlesning av potensialet for arbeidselektroden. Mellom disse to elektrodene har vi et system som ligner på en potensiometrisk analyse: det er statisk og ikke dynamisk.
Det kan tjene deg: Nukleær kjemi: Historie, studieretning, områder, applikasjonerPotensiell
Coulombimetry er så å si en elektrolyse utført for analytiske og kvantitative formål. Derfor er det snakk om å bruke eksterne potensialer, levert av et batteri, for å utføre ikke -spontane elektrokjemiske reaksjoner; det vil si de som har negative potensialer.
Tenk for eksempel følgende reaksjoner ledsaget av deres respektive potensielle standarder:
Cu2+ + 2e- ⇌ Cu (S) eºNett = +0.337 v
H2Eller ⇌ 1/2o2(g) + 2H+ + 2e- EºNett = +1.230 v
Å være ligningen for den globale reaksjonen lik:
Cu2+ + H2Eller ⇌ cu (er) + 1/2o2(g) + 2H+ EºNett = -0.893 v
Batteriet må bruke et potensial på 0.893 V slik at kobberelektrode og dannelse av hydrogenioner er mulig. Dette potensialet er Ecelle. I praksis må imidlertid et potensial som er større enn beregnet, brukes, fordi det er potensialer som er imot evolusjonen av reaksjonen:
OGcelle = Ekatode - OGAnode - OP - IR - CP
Hvor,
OP: Overpotensial (kinetisk barriere)
IR: Ohmic (iboende potensial til celler)
CP: Polarisering av konsentrasjoner (produkt av reduksjonene i Cu2+)
Typer coulombimetri
Det er tre typer coulombimetri: amperostatisk, potensiostatisk og elektrografisk elektravimetrisk.
Amperostatisk eller galvanostatisk
I denne typen coulombimetri er strømmen som går gjennom cellen konstant ved å bruke en amperostat. Derfor har strømmen Yo Takk til lesingen av ammeteret, og også å vite tiden t Når elektrolysen er slutt, kan vi beregne belastningen som er forbundet med transformasjonen av analytten:
Q = Punkt
En konsekvens av å holde strømmen konstant er at elektroder potensiell endring, enten positivt eller negativt. Denne plutselige variasjonen er en indikasjon på at analytten har reagert fullstendig, og det er når elektrolyse stopper og måles t. Dette er grunnlaget for coulometriske grader.
Hvis potensialet fortsetter eller laster opp, vil andre uønskede elektroaktive arter ende opp med å reagere. Det er grunnen til at potensialene forbundet med transformasjonene av interesse skal være kjent perfekt.
Potensiostatisk
En måte å forhindre andre arter. Det er her Potentiosotic Coulombimetry kommer inn, fordi den bruker en potensiostete for å sette et visst potensial for cellen. I motsetning til amperostatisk coulombimetri, er det nå strømmen som endres etter hvert som tiden finner sted.
Kan tjene deg: toluen: struktur, egenskaper, bruk, innhentingPå grunn av denne tekniske konfigurasjonen kan vi ikke beregne det direkte med verdiene til Yo og t; Strømmen avtar over tid. Dette skyldes at når analytten reagerer, vil det være mindre og færre molekyler eller atomer som donerer eller aksepterer elektroner. Derfor, som er lik et integrert område under grafikkurven Yo vs t.
Elektrografisk
Elektrografisk coulombimetri, ganske enkelt kjent som elektravimetri, er en elektrolyse der det ikke er nødvendig å måle belastninger eller elektriske strømmer. I stedet måles massene av elektrodene før og etter elektrolyse.
Denne teknikken gjelder bare når arten som er redusert er metallkationer som er elektrodepoer på elektrodene, noe som gjør dem tyngre.
applikasjoner
Potensiostetisk
Potentiostetiske analyser tillater å redusere eller oksidere selektiv en art om gangen midt i en blanding. For eksempel brukes de til å bestemme konsentrasjonen av følgende uorganiske ioner i spormengder, eller i komplekse matriser:
-Cu2+
-Ess3+
-CD2+
-Co2+
-Tro2+ og tro3+
-Pb2+
-X (f-, Cl-, Br- og jeg-)
-Ingen2+
-PU3+
-AG+
-Sn2+
-Zn2+
-ELLER6+
Disse analysene kan også brukes til å bestemme sammensetningen av en legering. Når syrelegeringen er oppløst, blir cellepotensialer brukt på en forskjøvet og kontrollert måte, og bestemmer dermed den reduserte mengden for hver metallkation som integrerer den.
Coulometric grader
I de kulometriske gradene brukes formidlingsmidler som sørger for å nøytralisere eller reagere med den gjenværende analytten fullstendig. Hensikten med dette er å forhindre potensielle variasjoner, til en konstant strøm, stammer i sikkerhetsreaksjoner. Dermed er det mulig holder, for eksempel askorbinsyre ved bruk av jod som mekler.
Noen metallkationer, for eksempel AG+, Ec3+, Tro3+, Mn2+, Du3+, Cr2+, De kan også bestemmes av disse grader.
På den annen side kan syre-base-reaksjoner fortsatt bruke denne teknikken, siden store potensialer får vann til å være ionisk3ENTEN+ eller åh-, som tjener fra tittelagenter som genereres in situ; det vil si at de vil nøytralisere syrene eller basene som er til stede.
Co2 Av havet er nedbørreaksjonene og dannelsen av komplekser med EDTA også mulig å analysere dem ved å bruke coulometriske grader, der redoksindikatorer tilsettes for å fremheve det endelige punktet for elektrolyse.
Referanser
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kjemi (Femte utg.). Pearson Prentice Hall.
- Skoog d.TIL., Vest d.M. (1986). Instrumental analyse. (Second Ed.). Inter -amerikansk., Mexico.
- Dr. Doug Stewart. (2020). Definisjon av Coulometry. Gjenopprettet fra: Chemicool.com
- Wikipedia. (2020). Coulometry. Hentet fra: i.Wikipedia.org
- Harvey David. (5. juni 2019). Coulometriske metoder. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Metodologiske rammer hvordan du skriver det, struktur, eksempler
- Samtidsfilosofi opprinnelse, egenskaper, strømmer, forfattere »

