Bowman kapselstruktur, histologi, funksjoner
- 2161
- 413
- Markus Fredriksen
De Bowman Capsule Det representerer det innledende segmentet av den rørformede komponenten i nefronet, anátomo-funksjonell enhet i nyren der prosessene som er bestemt til urinproduksjon utføres og som nyren bidrar til bevaring av organismenes homeostase.
Den ble navngitt til ære for den engelske oftalmologen og anatomistlegen Sir William Bowman, som oppdaget dens eksistens og publiserte sin histologiske beskrivelse for første gang i 1842.
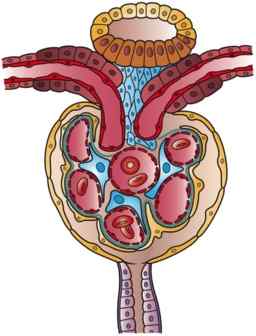
 Illustrasjon av en nefron (kilde: kunstverk av Holly Fischer [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] via Wikimedia Commons)
Illustrasjon av en nefron (kilde: kunstverk av Holly Fischer [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] via Wikimedia Commons) Det er en viss forvirring i litteraturen i forhold til nomenklaturen til de innledende segmentene i nefronet, blant dem Bowman -kapselen er inkludert. Noen ganger beskrives det som en annen del av glomerulus og utgjør med den nyre corpuscle, mens den for andre har en funksjon som medlem av Glomerulus.
Uansett at kapselen i de anatomiske beskrivelsene er en del av Glomerulus, er faktum at begge elementene er så intimt assosiert i sin struktur og funksjon, at begrepet Glomerulus våkner i hvem som mener ideen om en sfæritt med sin Fartøy.
Hvis ikke, ville kapselen ganske enkelt være en beholder der væsken som ble filtrert i glomerulus, helles, men den ville ikke ha en del i den samme glomerulære filtreringsprosessen. Noe som ikke er slik, siden hun, som vil bli sett, er en del av den prosessen hun bidrar til på en spesiell måte.
[TOC]
Struktur og histologi
Bowmans kapsel er som en liten sfære hvis vegg er invaginert i vaskulær sektor. I denne invaginasjonen blir kapselen penetrert av hårsnacks, som har sin opprinnelse i den afferente arteriolaen og som bringer blod til glomerulus, der den eferente arteriola som tar blodet fra Glomerulus også kommer ut.
Den motsatte enden av kapselen, kalt urinstang, presenteres som om veggen i sfæren hadde et hull som enden av det første segmentet som begynner den rørformede funksjonen, det vil si den proksimale konturerte tubulen er tilkoblet.
Denne ytre veggen i kapselen er et flatt epitel og kalles parietalpitelet til Bowman -kapselen. Endre struktur når du gjør overgangen til epitel av den proksimale tubulen i urinstangen og mot visceralt epitel i vaskulær pol.
Kan tjene deg: soppiform papillerDet invagerte epitelet kalles visceral fordi det pakker de glomerulære kapillærene som om de var en viscera. Det dannes av celler som kalles podocytter som omfavner, dekker dem, til kapillærene og som har veldig spesielle egenskaper.
Podocyttene er organisert i et enkelt lag, og slipper ut forlengelser som internerer med utvidelsene av nabo -podocytter, og etterlater mellomrom mellom dem kalt porer i spalte eller filtreringsspalmer og som er kontinuitetsløsninger for trinnet i filtrering.
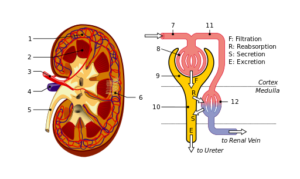 Nyr- og nefronstruktur: 1. Renal cortex; 2. Marg; 3. Nyrearterie; 4. Nyrevener; 5. Ureter; 6. Nefroner; 7. Afferent arteriola; 8. Glomerulus; 9. Bowman Capsule; 10. Tubules og Hanle gjør; elleve. Peritubulære kapillærer (kilde: Fil: Physiology_of_nephron.SVG: Madhero88File: Nyrerrurtures_piom.SVG: Piotr Michał Jaworski; Piom i plderivativt arbeid: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Nyr- og nefronstruktur: 1. Renal cortex; 2. Marg; 3. Nyrearterie; 4. Nyrevener; 5. Ureter; 6. Nefroner; 7. Afferent arteriola; 8. Glomerulus; 9. Bowman Capsule; 10. Tubules og Hanle gjør; elleve. Peritubulære kapillærer (kilde: Fil: Physiology_of_nephron.SVG: Madhero88File: Nyrerrurtures_piom.SVG: Piotr Michał Jaworski; Piom i plderivativt arbeid: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) Podocytter og endotelceller som dekker en basal membran som de støtter på, og også har kontinuitetsløsninger for passering av vann og stoffer. Endotelceller er fenestradas og tillater også filtrering.
Så disse tre elementene: kapillær endotel, basal membran og visceral epitel i Bowman -kapselen, utgjør membranen eller filtreringsbarrieren sammen.
Funksjoner
Kapsel er assosiert med den glomerulære filtreringsprosessen. På den ene siden, fordi det er en del av epiteldekselet til podocytter som omgir de glomerulære kapillærene. Det bidrar også til syntesen av basalmembranen som dette epitelet og det glomerulære kapillærendotelet støttes.
Disse tre strukturene: kapillær endotel, basal membran og visceralt epitel i Bowman -kapselen, utgjør den såkalte membranen eller filtreringsbarrieren, og hver av dem har sine egen permeabilitetsegenskaper som bidrar til den globale selektiviteten til den barrieren.
I tillegg bestemmer volumet av væske som trenger inn i Bowman -rommet, sammen med graden av stivhet som den kapsulære ytre veggen motsetter.
Kan tjene deg: periosteum: Kjennetegn, funksjoner og histologiDeterminanter for størrelsen på den glomerulære filtrering
En variabel som samler størrelsen på den glomerulære filtreringsprosessen er det så -kalt glomerulære filtreringsvolumet (VFG), som er volumet av væske som er filtrert i all glomeruli i tidsenheten. Den gjennomsnittlige normalverdien er omtrent 125 ml/min eller 180 l/dag.
Størrelsen på denne variabelen bestemmes ut fra det fysiske synspunktet av to faktorer, nemlig den så -kallede filtrering eller ultrafiltrering (KF) -koeffisienten og det effektive filtreringstrykket (PEFF). Det vil si: VFG = KF X PEFF (ligning 1)
Filtreringskoeffisient (KF)
Filtreringskoeffisienten (KF) er et produkt av hydraulisk konduktivitet (LP), som måler vannpermeabiliteten til en membran i ml/min per enhet og enhet for implementering av trykk, ved overflatearealet (a) til filtermembranen, det vil si KF = LP X A (ligning 2).
Størrelsen på filtreringskoeffisienten indikerer væskevolumet som er filtrert per tidsenhet og per enhet med effektiv drivkraft. Selv om det er veldig vanskelig å måle direkte, kan det oppnås fra ligning 1, og dele VFG/PEFF.
KF i de glomerulære kapillærene er 12,5 ml/min/mmHg per c/100 g vev, verdi omtrent 400 ganger høyere enn KF for andre kapillærsystemer i kroppen, hvor du kan filtrere omtrent 0,01 ml/min/mm Hg per 100 g stoff. Sammenligning som viser glomerulær filtreringseffektivitet.
Effektivt filtreringstrykk (PEFF)
Det effektive filtreringstrykket representerer resultatet av den algebraiske summen av de forskjellige trykkkreftene som favoriserer eller motsetter seg filtrering. Det er en hydrostatisk trykkgradient (ΔP) og et annet osmotisk trykk (onkotisk, Δп) bestemt av tilstedeværelsen av proteiner i plasma.
Den hydrostatiske trykkgradienten er trykkforskjellen mellom innsiden av den glomerulære kapillæren (PCG = 50 mm Hg) og Bowman Capsule Space (PCB = 12 mm Hg). Som sett er denne gradienten rettet fra kapillæren til kapsel og fremmer forskyvning av væske i den forbindelse.
Kan tjene deg: appendikulært skjelett: funksjoner og beinDen osmotiske trykkgradienten beveger væske mindre til høyere osmotisk trykk. Bare partikler som ikke filter utøver denne effekten. Proteiner filtrerer ikke. Dens пcb er 0 og i den glomerulære kapillæren er den 20 mm Hg. Denne gradienten flytter væske fra kapselen til kapillæren.
Det effektive trykket kan beregnes ved å bruke PEFF = ΔP-Δп; = (PCG-PCB)-(пcg-пcb); = (50-12)-(20-0); = 38-20 = 18 mm Hg. Det er derfor et effektivt eller netto filtreringstrykk på omtrent 18 mm Hg som bestemmer en VFG på omtrent 125 ml/min.
Filtreringsindeks (hvis) av stoffene som er til stede i plasmaet
Det er en indikator på lettheten (eller vanskeligheten) som et stoff som er til stede i plasmaet, kan krysse filtreringsbarrieren. Indeksen oppnås ved å dele konsentrasjonen av stoffet i filtrering (FX) mellom konsentrasjonen i plasma (PX), det vil si: IFX = FX/ PX.
Området for IF -verdier er mellom maksimalt 1 for de stoffene som filtrerer fritt, og 0 for de som ikke filtrerer noe. Mellomverdier er for partikler med mellomvansker. Jo nærmere 1 verdien, jo bedre er filtreringen. Nærmere 0, vanskeligere å filtrere.
En av faktorene som bestemmer IF er størrelsen på partikkelen. De som har diametre mindre enn 4 nm filtrerer fritt (hvis = 1). Når størrelsen vokser og nærmer seg albuminet, reduseres Fe. Albuminstørrelsespartikler, eller større, har 0 hvis 0.
En annen faktor som hjelper til med å bestemme IF er negative elektriske belastninger på molekyloverflaten. Proteiner har mye negativ belastning, noe som blir lagt til deres størrelse for å hindre deres filtrerbarhet. Årsaken er at porene har negative ladninger som avviser proteiner.
Referanser
- Ganong WF: Renal Function and Micturition, i Gjennomgang av medisinsk fysiologi, 25. utg. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall Ji: Urinsystemet, i Lærebok for medisinsk fysiologi , 13. utg, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, i Physiologie des Menschen Mite Pathophysiologie, 31. Ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl s: die funekction der nieren, i Fysiologi, 6. utg; R Klinke et al (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl Rak et al: Niere Undoitende Harnwege, i Klinche Pathophysiologie, 8. utg, W Siegenthaler (Ed). Stuttgart, Georg Thieme Verlag, 2001.
- « Hva er fibrøse skjøter? Typer og egenskaper
- Baronnosia Origin, Concept, Test, Relaterte lidelser »

