Sinkkromatstruktur, egenskaper, innhenting, bruker
- 3156
- 505
- Thomas Karlsen
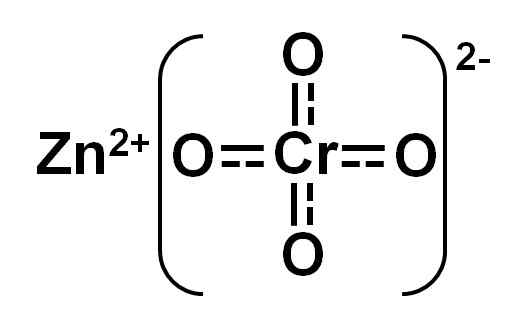
Han sinkkromat O CINC -kromat er en uorganisk forbindelse dannet av sink (Zn), krom (CR) og oksygen (O) elementer (O). Den har Zn -ionene2+ og CRO42-. Den kjemiske formelen er Zncro4.
Begrepet 'kromat av sink' kommersielt tjener til å utpeke tre forbindelser med forskjellig molekylstruktur: (a) Kromatet til sink riktig Zncro4, (b) Det grunnleggende kromatet til FIFCRO4• 4ZN (OH)2, og (c) det grunnleggende kromatet for sink og 3zncro kalium4• Zn (OH)2• k2Cro4• 2H2ENTEN.
 Sinkkromatstruktur. Forfatter: Marilú Stea.
Sinkkromatstruktur. Forfatter: Marilú Stea. Det brukes hovedsakelig i malerier eller midler som beskytter korrosjonsmetaller. For å gjøre dette er det blandet med malerier, lakker og polymerer som deretter påføres på overflaten av metallene.
Det brukes også i dekorative og beskyttende finish oppnådd med andre kromater og syrer som belegger forskjellige gjenstander som verktøy. Det tjener også til å beholde den elektriske konduktiviteten til metalldeler.
Det brukes som en katalysator i hydrogeneringsreaksjoner (tilsetning av hydrogen) i organiske forbindelser. Det er en del av pigmentene som tidligere ble brukt i kunstneriske malerier.
Det er et materiale som produserer kreft, og dette er fordi kromatet har krom i oksidasjonstilstand +6.
[TOC]
Struktur
 Zincros kromat4 Det er en gul forbindelse. Forfatter: Marilú Stea.
Zincros kromat4 Det er en gul forbindelse. Forfatter: Marilú Stea. Sinkkromatet er en ionisk forbindelse dannet av den femten kation Zn2+ og cromato -anionen42-. Sistnevnte er dannet av krom med Valencia +6 (heksavalent krom, CR6+) og fire oksygenatomer med oksidasjonstilstand -2.
Zn -ionet2+ Den har følgende elektroniske struktur:
1s2, 2s2 2 s6, 3s2 3p6 3d10.
For sin del har det heksavale krom i sine elektroniske orbitaler følgende konformasjon:
1s2, 2s2 2 s6, 3s2 3p6.
Begge strukturer er veldig stabile ettersom orbitaler er komplette.
Nomenklatur
- Sinkkromat
- Kromsyre sinksalt
- Sinkgul (selv om andre forbindelser med dette begrepet som inneholder Zncro også kalles4).
Egenskaper
Fysisk tilstand
Gul sitrongul krystallinsk faststoff. Prismer -formede krystaller.
Molekylær vekt
181,4 g/mol
Smeltepunkt
316 ºC
Tetthet
3,40 g/cm3
Løselighet
Vannløselig i vann: 3,08 g/100 g h2ENTEN. Det blir lett oppløst i syrer og flytende ammoniakk. Uoppløselig i aceton.
Kan tjene deg: ionisering konstantPh
I følge noen kilder er deres vandige oppløsninger sure.
Kjemiske egenskaper
Det er en sterkt oksiderende forbindelse, så den kan reagere med reduksjonsmidler som genererer varme. Blant stoffene som de organiske kan reagere, for eksempel cyanider, estere og tiocianater. Du kan også angripe noen metaller.
I vandig løsning presenterer kromatet forskjellige balanser avhengig av pH og danner forskjellige arter.
Arter dannet av kromat
Over pH 6 er til stede cromato -ionen42- (gul); Mellom pH 2 og pH 6 er hcro -ionet i likevekt4- og Cr dikromat2ENTEN72- (oransje rød); ved pH mindre enn 1 er hovedarten h2Cro4.
Når sink (II) kation tilsettes disse vandige oppløsningene, utfeller Zncro4.
Saldoen er som følger:
Hcro4- ⇔ Cro42- + H+
H2Cro4 ⇔ Hcro4- + H+
Cr2ENTEN72- + H2Eller ⇔ 2 hcro4-
I grunnleggende medium skjer følgende:
Cr2ENTEN72- + Åh- ⇔ Hcro4- + Cro42-
Hcro4- + Åh- ⇔ Cro42- + H2ENTEN
Zncro4 Den reagerer ikke raskt med luft eller vann.
Å skaffe
Det kan produseres ved å reagere en vandig gjørme av sinkoksid eller hydroksyd med et oppløst kromatsalt og deretter nøytralisere.
Industrielt brukes cronak -prosessen, der metalltåken er nedsenket i en natriumdikromatoppløsning (NA2Cr2ENTEN7) og svovelsyre (h2SW4).
Det kan også fremstilles ved å utfelle den fra løsninger der det er oppløst sink og kromatsalter:
K2Cro4 + Znso4 → Zncro4↓ + k2SW4
applikasjoner
I metallbeskyttelse
I den metallurgiske industrien brukes det hovedsakelig i bakgrunnsmalerier (forberedende maling eller innledende belegg) påført metaller, som det gir korrosjonsmotstand.
Det brukes som et pigment i malerier og lakk, og settes inn i matrisen til en organisk polymer.
Denne typen maling administreres til rør, oljetanker, stålkonstruksjoner som broer, elektriske kraftoverføringstårn og bildeler for å hemme korrosjon.
 Bridge stålkonstruksjoner er malt med en sinkkromatbase før den endelige malingen for å beskytte dem mot korrosjon. Forfatter: オギクボ マンサク. Kilde: Pixabay.
Bridge stålkonstruksjoner er malt med en sinkkromatbase før den endelige malingen for å beskytte dem mot korrosjon. Forfatter: オギクボ マンサク. Kilde: Pixabay. Passivering
Det er også å beskytte metallkomponenter dekket med sink som har blitt passert ved hjelp av alkalisk metallkromater. Passivasjon består i tap av kjemisk reaktivitet under visse miljøforhold.
Kan tjene deg: elektrokjemiske cellerDisse beleggene fungerer også som dekorative utførelser og for å beholde elektrisk ledningsevne. De gjelder ofte for daglige artikler som verktøy og kan gjenkjennes av den gule fargen.
 Noen verktøy er dekket med sinkkromat. Forfatter: Duk. Kilde: Wikimedia Commons.
Noen verktøy er dekket med sinkkromat. Forfatter: Duk. Kilde: Wikimedia Commons. Hvordan virker det
Enkelte etterforskere fant at beskyttelsen mot korrosjon av metaller utført av FI -chromate kan skyldes at det hemmer veksten av sopp. På denne måten forverringen av det anti -korrosive malingsbelegget.
Andre studier indikerer at den antikorrosive effekten kan være fordi forbindelsen akselererer dannelsen av beskyttende oksider på metaller.
 Sinkkromat antikorrosiv bakgrunn for metalloverflatebeskyttelse. 水水/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Sinkkromat antikorrosiv bakgrunn for metalloverflatebeskyttelse. 水水/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Reaksjoner katalyse
Denne forbindelsen har blitt brukt som katalysator i forskjellige kjemiske reaksjoner, for eksempel karbonmonoksidhydrogenering (CO) for å oppnå metanol (CH3ÅH).
Esterne kan konverteres til primære alkoholer ved hydrogenering, ved å bruke denne forbindelsen for å akselerere reaksjonen.
I følge noen forskere skyldes dens katalytiske virkning at fastet ikke presenterer en støkiometrisk struktur, det vil si at det avviker fra sin Zncro -formel4 Og det er snarere:
Zn1-XCr2-XENTEN4
Noe som innebærer at det er feil i strukturen som energisk favoriserer katalyse.
Andre apper
Det finnes i noen fete fargestoffer, det tjener til å trykke, det er et middel for overflatebehandling, det brukes i gulv av gulv og er et reagens i kjemiske laboratorier.
Utgitt bruk
Siden 1940 -tallet ble et Zncro -derivat brukt4, Sink og kobberkromat, som blad soppmiddel for potetplanter.
 Paveplanter. Forfatter: Dirk (Beeki®) Schumacher. Kilde: Pixabay.
Paveplanter. Forfatter: Dirk (Beeki®) Schumacher. Kilde: Pixabay. Denne bruken er allerede forlatt av toksisiteten og skadelige effektene av forbindelsen.
I kunstneriske malerier fra det nittende århundre er tilstedeværelsen av komplekst sinkkromatsalt funnet, 4ZNCRO4• k2Eller • 3H2O (sinkkromat og hydratisert kalium), som er et gult pigment som kalles sitrongult.
Kan tjene deg: litiumklorid (LICL): Egenskaper, risikoer og bruksområderRisiko
Selv om det ikke er drivstoff, avgir den giftig gasser når den blir oppvarmet. Kan eksplodere hvis du kommer i kontakt med reduksjonsmidler eller organiske materialer.
Støv irriterer øyne og hud som produserer allergisk reaksjon. Innånding forårsaker irritasjon av nese og hals. Det påvirker lungene, forårsaker forkortelse, bronkitt, lungebetennelse og astma.
Inntaket påvirker fordøyelseskanalen, leveren, nyrene, sentralnervesystemet, produserer en sirkulasjonskollaps og skader immunforsvaret.
Kreftgenerator
Det er et bekreftet karsinogen, øker risikoen for lungekreft og nesehulen. Det er giftig for celler (cytotoksisk) og skader også kromosomer (genotoksisk).
 Sinkkromat produserer lungekreft og luftveier. Forfatter: OpenClipart-vektorer. Kilde: Pixabay.
Sinkkromat produserer lungekreft og luftveier. Forfatter: OpenClipart-vektorer. Kilde: Pixabay. Det er bestemt at toksisiteten og kreftfremkallende. Tilstedeværelsen av CINC gir imidlertid uløseligheten til produktet, og dette påvirker også skaden det produserer.
Effekter på miljøet
Det er veldig giftig for dyr og for vannlevende liv, noe som forårsaker skadelige effekter som varer over tid. Denne kjemikeren kan bioakumuleres i hele næringskjeden.
Av alle disse grunnene reguleres prosessene som involverer kromater (heksavalt krom) av Verdens helseorganisasjoner og erstattet av alternative teknikker uten dette ionet.
Referanser
- ELLER.S. National Library of Medicine. (2019). Sinkkromat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Xie, h. et al. (2009). Sinkkromat induterer kromosom ustabilitet og DNA doble Strad bryter i humane LUN -celler. Toxicol Appl Pharmacol 2009 1. februar; 234 (3): 293-299. NCBI kom seg.NLM.NIH.Gov.
- Jackson, r.TIL. et al. (1991). Den katalytiske aktiviteten og defektstrukturen til sinkkromat. Catal Lett 8, 385-389 (1991). Lenke gjenopprettet.Springer.com.
- Yahalom, J. (2001). Korrosjonsbeskyttelsesmetoder. I Encyclopedia of Materials: Science and Technology. Gjenopprettet fra Scientedirect.com.
- Stranger-Johannessen, m. (1988). Den antimikrobielle effekten av pigmenter i korrosjonsbeskyttende maling. I Houchton d.R., Eggins, h.ENTEN.W. (Eds) Biodeterioration 7. Lenke gjenopprettet.Springer.com.
- Barrett, a.G.M. (1991). Reduksjon. I å forstå organisk syntese. Gjenopprettet fra Scientedirect.com.
- Torsdag, h.W. et al. (1948). Kromater som potet soppdrepende midler. American Potato Journal 25, 406-409 (1948). Lenke gjenopprettet.Springer.com.
- Lynch, r.F. (2001). Sink: legering, termokjemisk prosessering, egenskaper og applikasjoner. I Encyclopedia of Materials: Science and Technology. Gjenopprettet fra Scientedirect.com.
- Ramesh Kumar, a.V. og nigam, r.K. (1998). Mössbauer spektroskopi studie av korrosjonsprodukter under første belegg som inneholder antikorrosive pigmenter. J Radioanal Nucl Chem 227, 3-7 (1998). Lenke gjenopprettet.Springer.com.
- Otero, v. et al. (2017). Barium, sink og stontium gule i slutten av 1800-tallet oljemalerier fra det 20. århundre. Herit Sci 5, 46 (2017). Gjenopprettet fra HeritagescienceJournal.Springeropen.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Wikipedia (2020). Sinkkromat. Innhentet fra.Wikipedia.org.
- Wikipedia (2020). Kromatkonverteringsbelegg. Innhentet fra.Wikipedia.org.
- « Stillehavsbrannbelte, egenskaper, hovedvulkaner
- Sinkklorid (ZnCL2) struktur, egenskaper, innhenting, bruk »

