Krom (CR)

- 1425
- 22
- Anders Mathisen
 Chrome er et veldig reaktivt metall. Wikimedia Commons
Chrome er et veldig reaktivt metall. Wikimedia Commons Hva er krom?
Han krom (CR) er et kjemisk element i gruppe 6 (vib) i det periodiske tabellen. Årlig tonn av dette metallet produseres ved ekstraksjon av kromitt eller magnesiummineral (FECR2ENTEN4, Mgcr2ENTEN4), som reduseres med kull for å oppnå metall. Det er veldig reaktivt, og bare under veldig reduserende forhold er det i sin rene form.
Dets mineraler og oksider, i tillegg til en liten metallkobberdel, gjør at dette elementet okkuperer tallet 22 av de mest tallrike av jordens cortex.
Kromkjemi er veldig mangfoldig fordi den kan danne koblinger med nesten hele periodiske bord. Hver av forbindelsene viser farger som er avhengige av oksidasjonsnummeret, så vel som arten som samhandler med det.
Form også koblinger til karbon, og griper inn i et stort antall organethaliske forbindelser.
Kromegenskaper og egenskaper
Krom er et sølvmetall i sin rene form, med atomnummer 24 og en molekylvekt på omtrent 52 g/mol (52Cr, dens mest stabile isotop).
Gitt sine sterke metallforbindelser, presenterer den fusjonspunkter (1907 ºC) og kokende (2671 ºC) høy. Også den krystallinske strukturen gjør den til et veldig tett metall (7.19 g/ml).
Den reagerer ikke med vann for å danne hydroksider, men med syrer. Det oksiderer med oksygenet i luften som generelt produserer kromoksid, som er et mye brukt grønt pigment.
Disse oksydlagene skaper det som er kjent som Passivering, Beskytte metallet mot påfølgende korrosjoner, siden oksygen ikke kan trenge gjennom metall sinus.
Den elektroniske konfigurasjonen er [AR] 4S13d5, Med alle manglende elektroner, og derfor viser den paramagnetiske egenskaper. Imidlertid kan parring av elektroniske spinn oppstå hvis metall blir utsatt for lave temperaturer, og får andre egenskaper, for eksempel antiferromagnetisme.
Kan tjene deg: ildfaste materialerKjemisk kromstruktur
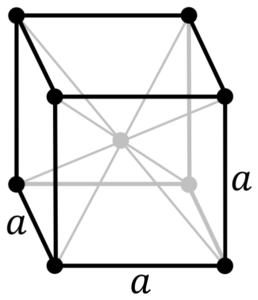 Krom metallstruktur. Kilde: av Original PNGS av Daniel Mayer, DrBob, Wikimedia Commons
Krom metallstruktur. Kilde: av Original PNGS av Daniel Mayer, DrBob, Wikimedia Commons Hva er strukturen til krommetall? I sin rene form vedtar krom en kubikk krystallinsk struktur sentrert på kroppen (CC eller BCC). Dette betyr at kromatomet er lokalisert i midten av en kube, hvis kanter er okkupert av andre kromer (som i det overordnede bildet).
Denne strukturen er ansvarlig for at krom har høye smelte- og kokepunkter, samt stor hardhet. Kobberatomer overlapper sine s og d orbitaler for å danne drivende bånd i henhold til bandteori.
Dermed er begge båndene fulle i to fordi deres elektroniske konfigurasjon er [AR] 4S13d5, Og som orbital S, kan huse to elektroner, og orbitalene til ti. Da er bare halvparten av båndene som er dannet av overlappene sine okkupert av elektroner.
Med disse to perspektivene -den krystallinske strukturen og den metalliske lenken -kan de fysiske egenskapene til dette metallet forklares i teorien. Imidlertid forklarer ingen av dem hvorfor krom kan ha flere stater eller oksidasjonstall.
For dette er en dyp forståelse av atomets stabilitet med hensyn til elektroniske spinn.
Kromoksidasjonsnummer
Fordi krom elektronisk konfigurasjon er [AR] 4S13d5 Du kan vinne opptil en eller to elektroner (CR1- og Cr2-), eller miste dem for å skaffe forskjellige oksidasjonstall.
Så hvis krom mister et elektron, ville det være som [AR] 4S03d5; Hvis du mister tre, [ar] 4s03d3; Og hvis du mister dem alle, [ar], eller hva som er det samme, ville det være isolektronisk å argon.
Kan tjene deg: Kokingspunkt: Konsept, beregning og eksemplerKrom mister ikke eller får elektroner på grunn av bare innfall: det må være en art som gjøres eller aksepterer dem for å gå fra ett oksidasjonsnummer til et annet.
Kromiet har følgende oksidasjonstall: -2, -1, 0, +1, +2, +3, +4, +5 og +6. Av dem +3, CR3+, Det er den mest stabile og derfor den dominerende av alle; etterfulgt av +6, CR6+.
Chrome bruker
Som fargestoff eller pigment
Kromiet har et bredt spekter av applikasjoner, fra fargestoff for forskjellige typer stoffer, til beskytteren som forskjønner metallstykkene, i det som er kjent som forkrommet, som kan gjøres med rent metall, eller med CR -forbindelser (III) eller CR (Vi).
Cromic Fluoruro (CRF3) for eksempel brukes det som fargestoff for ullkluter; Cromic sulfat (CR2(SW4)3), er den bestemt til å fargelegge emaljer, keramikk, malerier, blekk, lakk, og tjener også til kromarmetaller; og kromoksid (CR2ENTEN3) Finn også bruk der den attraktive grønne fargen er nødvendig.
Derfor kan ethvert krommineral med intense farger være bestemt til å farge en struktur, men etter det faktum om disse forbindelsene er farlige eller ikke for miljøet eller for individeres helse.
Faktisk brukes dens giftige egenskaper til å spare tre og andre insektangrepsflater.
I forkrommet eller metallurgi
På samme måte tilsettes små mengder krom til stål for å styrke det i møte med oksidasjon og for å forbedre lysstyrken. Dette er fordi det er i stand til å danne grå karbider (CR3C2) Veldig motstandsdyktig når du reagerer med oksygenet i luften.
Kan tjene deg: kalsiumhydroksyd (Ca (OH) 2): struktur, egenskaper, innhenting, brukFordi krom kan polere til lyse overflater, presenterer Chrome så sølvdesign og farger som et billigere alternativ for disse formålene.
Ernæring
Noe debatt om krom kan betraktes som et essensielt element, det vil si uunnværlig i det daglige kostholdet. Det er til stede i noen matvarer i veldig små konsentrasjoner, for eksempel grønne blader og tomater.
Det er også proteintilskudd som regulerer insulinaktivitet og favoriserer muskelvekst, som tilfellet er med Chrome Polynicotinato.
Hvor er krom?
Krom finnes i et stort utvalg av mineraler og perler, for eksempel rubiner og smaragder. Hovedmineralet som kromet er trukket ut fra er kromitten (MCR2ENTEN4), Hvor m kan være et hvilket som helst annet metall som kromoksid er assosiert med. Disse gruvene florerer i Sør -Afrika, i India, Tyrkia, Finland, Brasil og andre land.
Hver kilde har en eller flere kromittvarianter. På denne måten, for hver M (tro, Mg, Mn, Zn, etc.) Et annet krommineral oppstår.
For å trekke ut metallet er det nødvendig. Dette gjøres med karbon eller aluminium:
FECR2ENTEN4 + 4c => Fe + 2cr + 4CO
På samme måte er kromita funnet (PBCRO4).
Vanligvis i et hvilket som helst mineral der ion Cr3+ kan erstatte al3+, Både med litt like ioniske radioer, utgjør en urenhet som resulterer i en annen naturlig kilde til dette fantastiske, men skadelige metallet.
Referanser
- Tenebaum e. Krom. Hentet fra: Kjemi.Pomona.Edu
- Kjemi librettexts. Kjemi av krom. Hentet fra: Chem.Librettexts.org
- Krom. Tatt fra: ChemistryExplaed.com

