Hva er det mest elektronegative elementet og hvorfor?

- 4956
- 1213
- Oliver Christiansen
 Det mest elektronegative elementet er fluor (F), låst i den røde sirkelen
Det mest elektronegative elementet er fluor (F), låst i den røde sirkelen Han mer elektronegativt element I den periodiske tabellen er det Fluor, hvis kjemikalie er f og tilhører halogengruppen. Blant alle elementene i den periodiske tabellen er fluor den mest engstelige for å fange elektroner fra andre atomer.
Dette elementet, gassformig ved romtemperatur, er svært reaktivt, og det er derfor ikke lett å finne det i en ren tilstand i naturen. Fluor kobler seg enkelt med andre elementer som svovel, kalsium og metaller, samt mange forbindelser, spesielt de som inneholder hydrogen.
Den høye elektronegativiteten lar deg til og med kombinere med edelgasser som Xenon, Kripton og Radon.
Etter fluor er oksygen det andre elementet med høyest elektronegativitet. I kontrast er elementene med laveste elektronegativitet Francio (FR) og cesium (CS).
 Fordi det er det mest elektronegative elementet, danner fluor mange forbindelser, for eksempel fluoritt eller kalsiumfluorid. Kilde: Wikimedia Commons
Fordi det er det mest elektronegative elementet, danner fluor mange forbindelser, for eksempel fluoritt eller kalsiumfluorid. Kilde: Wikimedia Commons Disse er derfor de fleste elektropositiv som eksisterer, selv om Francio er radioaktiv og veldig lite rikelig i naturen.
Elektronegativitet og periodisk bord
Offektonegativiteten ble utviklet av kjemikeren og prisen Nobel Linus Pauling (1901-1994), selv om konseptet skyldes den svenske kjemikeren Jöns Jakob Berzelius (1779-1848).
Pauling -skalaen, som tildeler dimensjonale numeriske verdier til elektronegativitet, brukes til å måle intensiteten som et atom tiltrekker elektronet til et annet annet atom, og dermed danner koblinger.
Hvert element har sin egen elektronegativitet, som avhenger av atomegenskapene. Det bestemmes eksperimentelt og indirekte, for eksempel å måle koblingsenergi, slik Pauling gjorde rundt 1932.
På Pauling Electronegativities -skalaen er fluor først, med en omtrentlig verdi på 3.98 ≈ 4.0.
Kan tjene deg: Alifatiske hydrokarboner: egenskaper, nomenklatur, reaksjoner, typerElektronegativitet er en periodisk egenskap av elementene. I de fleste tilfeller (det er noen unntak), observeres det at elektronegativiteten øker når du går fra venstre til høyre gjennom rekkene i det periodiske tabellen.
Og også øke nedenfra og opp, ved å bevege seg på en kolonne.
 Den periodiske tabellen for elektronegativiteter i henhold til Pauling -skalaen. Fluor er det mest elektronegative elementet, som ligger over og til høyre, mens Francio er det minst elektronegative av alle, eller det mest elektropositive, hvis den er foretrukket, og er i venstre og ned kolonne. Kilde: f. Zapata.
Den periodiske tabellen for elektronegativiteter i henhold til Pauling -skalaen. Fluor er det mest elektronegative elementet, som ligger over og til høyre, mens Francio er det minst elektronegative av alle, eller det mest elektropositive, hvis den er foretrukket, og er i venstre og ned kolonne. Kilde: f. Zapata. Fluorelektronegativitet
Årsaken til at fluor er det mest elektronegative elementet i det periodiske tabellen, skyldes dens elektroniske konfigurasjon (måten elektronene er ordnet i orbitaler rundt kjernen).
Denne konfigurasjonen er 1s22s22 s5, Så fluor har 5 elektroner i sitt ytterste lag.
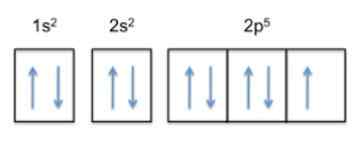
Nå, siden atomets trend er å fullføre det ytre laget, betyr det at fluoren vil akseptere et elektron av andre atomer med stor letthet, for å få stabilitet og ligne den edle gassen på samme rad, som er neon , hvis elektroniske konfigurasjon er 1s22s22 s6.
Fluoratom har en veldig liten radius, siden protonene i kjernen deres tiltrekker seg elektroner veldig sterkt, og holder dem nærmere enn i atomene til mindre elektronegative elementer, for eksempel cessium og francio.
Derfor er sistnevnte villige til å gi opp elektroner lett for å danne lenker.
Referanser
- Aguilar, c. Veiledning for den kjemiske læringsenheten i. Hentet fra: IPN.MX.
- Atkins, p. (2005). Prinsipper for kjemi, oppdagelsesveiene. 3. Utgave. Pan -American Medical Editorial.
- Clark, J. Elektronegivitet. Gjenopprettet fra: Chem.Librettexts.org.
- Hein, m. (2014). Grunnlag for college kjemi. 14. utg. Wiley.
- Lentech. Kjemiske elementer bestilt av elektronegativiteten. Gjenopprettet fra: Lentech.er.

