Kjemisk forbindelse
- 1373
- 376
- Prof. Oskar Aas
Vi forklarer hva de kjemiske koblingene er, typene som eksisterer, og vi gir mange eksempler
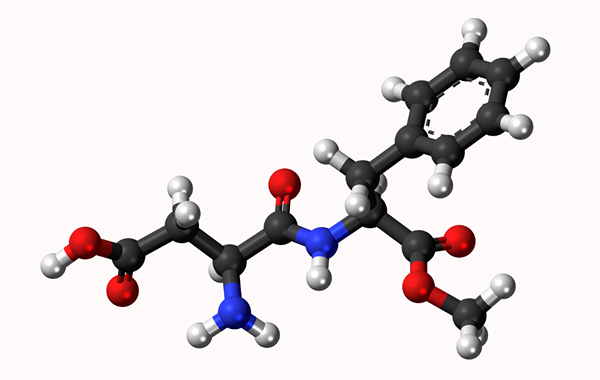
 Aspartamo Molecular Model: Enkel link representert med en linje og dobbeltbinding med to linjer. Ballene er atomer
Aspartamo Molecular Model: Enkel link representert med en linje og dobbeltbinding med to linjer. Ballene er atomer Hva er en kjemisk binding?
EN Kjemisk forbindelse Det er kraften som holder sammen med atomene i en forbindelse. Kraften som forener atomer er elektromagnetisk, og når atomene er bundet, beholder de sin egen natur.
For eksempel dannes vanlig vann på grunn av forening av to hydrogenatomer (h2) og en av oksygen (O); Det er grunnen til at den kjemiske formelen er h2ENTEN. Selv om de er forent for å danne vann, forblir hydrogenatomer hydrogen og oksygen er fremdeles oksygen.
Husk at atomer er dannet av en kjerne omgitt av en sky av elektroner, som har en negativ belastning. Atomkjernen har en positiv ladning, som klarer å tiltrekke elektroner.
Imidlertid er elektroner også tiltrukket av kjernene til andre atomer. Slik dannes kjemiske koblinger. Det faktum at atomer gir eller deler elektroner genererer de forskjellige typene kjemiske koblinger.
I kjemiske bindinger gir atomer, vinner eller deler elektroner av det som kalles Valencia Layer, som er det ytterste laget av et atom der reaktivitet oppstår eller tendensen til å danne kjemiske bindinger.
Disse koblingene lager nye stoffer (ikke blandinger) som ikke kan skilles gjennom teknikker som sil eller filtrering.
Kjemiske bindingstyper
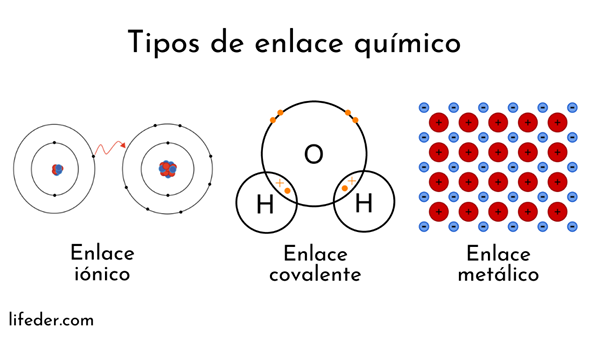
Atomer dannes av en kjerne (med positiv elektrisk ladning) og elektroner (partikler med negativ elektrisk ladning) som dreier seg om. Begge parter griper inn i kjemiske bindinger.
Kjemiske bindinger som involverer atomkjerner kalles metallisk. På den annen side er de som involverer elektronutveksling delt inn i ion og kovalent.
Kan tjene deg: Chlorbenzen (C6H5CL)Ioniske lenker
Denne typen koblinger er veldig motstandsdyktig; produserer faste kjemiske forbindelser (krystaller) i vannet og med et høyt smeltepunkt (mellom 300 og 1.000 grader Celsius). Oppløst i vann er de strømledere.
Hvordan er ioniske koblinger?

Ioniske bindinger forekommer mellom et metall og en ikke -metall som har forskjellig elektronegativitet (evne til å tiltrekke elektroner). Elektronene i Valencia -laget av det ene atom passerer til det andre atomet i Valencia. Som er det samme; Et metallisk atom gir et elektron til et ikke -metallisk atom, og oppnår elektronisk stabilitet.
Gjennom koblingsdannelsesprosessionene (kationer og anioner) er dannet, derav det ioniske bindingsnavnet.
Et eksempel på denne typen bindinger er natriumklorid: Denne kjemiske forbindelsen dannes når klor (CL) tiltrekker elektronet i valenslaget som har natriumatom (Na).
Et annet eksempel er manganklorid (MGC), som brukes til fremstilling av malerier og desinfeksjonsmidler. Som et resultat av den kjemiske bindingen blir elektronene til manganatomet absorbert av kloratom.
Kovalente lenker
De kovalente bindingene er veldig harde og genererer uoppløselige kjemiske forbindelser med en høy fusjonstemperatur (mer enn 1.000 grader Celsius). De driver ikke strøm.
I henhold til måten atomer deler sine elektroner, kan kovalente bindinger være:
- Enkel: De deler et par elektroner (A-A).
- Dobbelt: Del to elektronpar (a =).
- Trippel: Del tre elektronpar (A≡A).
Hvordan dannes kovalente bindinger?

Den kovalente bindingen dannes når to ikke -metalliske elementer deler elektroner i valenslaget.
Det kan tjene deg: Rubidio: Historie, egenskaper, struktur, innhenting, brukUtveksling av elektroner forekommer alltid på en slik måte at det samsvarer med oktettloven. Dette er et kjemisk prinsipp som sier at den mest stabile konfigurasjonen for et atom er en der den har åtte elektroner i sitt ytterste lag.
Et eksempel på kovalent binding er vann (h2ENTEN). For å lage vannmolekylet er det nødvendig med to enkle kovalente bindinger. I en enkel binding deles hydrogenelektronet med oksygen, og oksygen deler et elektron med hydrogen.
Et annet kovalent bindingseksempel er karbondioksid (CO2), en av hovedansvarene for drivhuset og klimaendringene. For å danne denne forbindelsen, skaper karbon og oksygen to dobbeltbindinger, det vil si for hver kobling to par elektroner deler.
Metallkoblinger
Denne typen lenker skjer bare i metallelementer. Den består av foreningen av kjernene av to atomer av det samme metalliske elementet sammen med elektronene deres.
Metallkoblinger er preget av å være effektive elektrisitetsledere, ha et veldig høyt fusjons- og kokepunkt, og lett oksidert. De er også formbare og motstandsdyktige mot riper, veldig solide og sterke.
Hvordan er metallkoblinger?
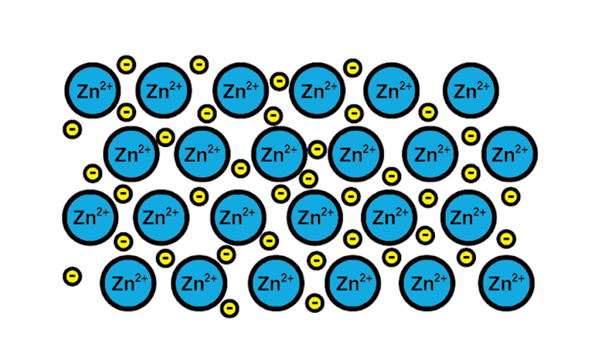 Sink metallisk lenke
Sink metallisk lenke Et eksempel på en metallisk kobling er sink, et metallisk element. Treningsprosessen for denne typen lenker er:
1-A atomkjerne av et metallisk element møter en annen kjerne av det samme elementet.
2-elektronene i Valencia-laget av begge kjerner blir et hav av elektroner rundt. Det vil si at de ikke går i bane rundt en eneste atomkjerne.
3-de positive belastningene på atomkjernene og negativene til elektronene tiltrekkes. Resultatet er valenselektroner som danner havet av elektroner rundt atomkjernene (kationer).
Det kan tjene deg: Kobbersulfat (CUSO4): Struktur, egenskaper, innhenting, brukEksempler på kjemiske bindinger
Ioniske lenker
- Bariumoksid (Bao).
- Magnesiumklorid (Mgcl2).
- Kalsiumoksid (CAO)
- Sølvnitrat (agno3)
- Sinkhydroksyd (ZnOH2)
- Kaliumbromid (KBR)
- Kalsiumkarbonat (Caco3)
- Kobbersulfat (CUO4)
- Litiumfluorid (LIF)
- Manganklorid (MNCL2)
- Kaliumsulfat (k2SW4)
- Jernoksid (stygt)
- Disodiumfosfat (Na2Hpo4)
- Kalium Ioduro (ki)
Kovalente lenker
- Karbondioksid (CO2)
- Ammoniakk (NH3)
- Parafin (CNH2N+2)
- Diesel (c12H26)
- Dibromo (Br2)
- Karbonmonoksid (CO)
- Butano (c4H10)
- Benzen (ca6H6)
- Molekylært nitrogen (n2)
- Metan (kap4)
- Saltsyre (HCl)
- Cyanhydrikkyre (HCN)
Metallkoblinger
Ethvert metall i sin rene tilstand er et eksempel på en metallisk kobling, nemlig:
- Nikkel (ni)
- Jern (tro)
- Aluminium (Al)
- Titanium (TI)
- Bly (PB)
- Kobolt (CO)
- Kobber (Cu)
- Sink (Zn)
- Kvikksølv (HG)
- Gull (AU)
- Sølv (AG)
- Barium (BA)
Viktigheten av kjemiske bindinger
Viktigheten av kjemiske bindinger er at de danner organiske og uorganiske molekyler, og på denne måten er de en del av basen til alle levende organismer. Hvis de blir utsatt for visse forhold, kan disse koblingene brytes. Denne energien kalles Link Energy.
Noen av teknikkene for å bryte koblingene brukes av elektrisitet, høye temperaturer eller provoserende kjemiske reaksjoner med forskjellige forbindelser.
For eksempel for å skille oksygen- og hydrogenmolekyler fra H2Eller vi kan bruke strøm på vannet, som er prosessen kjent som elektrolyse.
De kjemiske forbindelsene dannet av lenke er mange og er til stede i hverdagen. Saltet vi bruker for å krydre mat er et kjemisk sammensatt produkt av koblingen mellom et natrium (NA) og ett klor (CL) atom (CL). Den kjemiske formelen er NaCl, som leser natriumklorid.

