Oppvarmingskurve hva som er, hvordan det er, eksempler

- 4483
- 823
- Jonathan Moe
EN Oppvarmingskurve Det er den grafiske representasjonen av hvordan temperaturen på en prøve varierer som en funksjon av tiden, opprettholder det konstante trykket og tilfører varme jevnt, det vil si med en konstant hastighet.
For å bygge en slik graf tas par av temperatur- og tidsverdier, som deretter graferer temperaturen på den vertikale aksen (bestilt) og tiden på den horisontale aksen (abscissa).
 Figur 1. Oppvarmingskurven for et stoff oppnås ved å tilsette varme og måle temperaturen hver eneste tidsintervall. Kilde: Pixabay.
Figur 1. Oppvarmingskurven for et stoff oppnås ved å tilsette varme og måle temperaturen hver eneste tidsintervall. Kilde: Pixabay. Da justeres den mest passende kurven til disse eksperimentelle punktene, og til slutt oppnås en graf over T -temperaturen som en funksjon av tiden T: T (T).
[TOC]
Hva er varmekurven?
Når det varmer opp, går et stoff gjennom suksessivt forskjellige stater: å være solid kan damp, nesten alltid gå gjennom flytende tilstand. Disse prosessene kalles tilstandsendringer, der prøven øker dens indre energi mens den tilsetter varme, som indikert av den molekylære kinetiske teorien.
Ved å legge varme til en prøve er det to muligheter:
- Stoffet øker temperaturen, med tanke på at partiklene blir omrørt med større intensitet.
- Materialet går gjennom en faseendring, der temperaturen forblir konstant. Tilsett varme har effekten av å svekkes til en viss grad kreftene som holder partikler sammenhengende, så det er lett å passere fra is til flytende vann, for eksempel.
Figur 2 viser de fire tilstandstilstandene: fast, væske, gass og plasma og navnene på prosessene som tillater overgangen mellom hverandre. Pilene indikerer betydningen av prosessen.
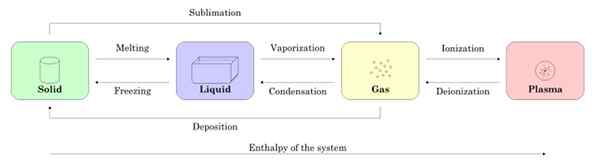 Figur 2. Statene i emnet og prosessene som er nødvendige for å passere mellom den ene og den andre. Kilde: Wikimedia Commons.
Figur 2. Statene i emnet og prosessene som er nødvendige for å passere mellom den ene og den andre. Kilde: Wikimedia Commons. -Tilstandsendringer i et stoff
Fra og med en prøve i fast tilstand, når smelting passerer til flytende tilstand, når den blir fordampet, blir den gass og gjennom ionisering blir det plasma.
Det kan tjene deg: magnetiske egenskaper til materialerDet faste stoffet kan direkte bli gass gjennom prosessen kjent som sublimering. Det er stoffer som lett sublim ved romtemperatur. Det mest kjente er co2 eller tørris, så vel som naftalen og jod.
Mens prøven krysser en tilstandsendring, forblir temperaturen konstant til den når den nye tilstanden. Dette betyr at hvis det for eksempel er en del av flytende vann som har nådd sitt kokepunkt, forblir temperaturen konstant til alt vannet har blitt damp.
Av denne grunn forventes varmekurven å være sammensatt av en kombinasjon av voksende seksjoner og horisontale seksjoner, der sistnevnte tilsvarer faseendringene. Figur 3 viser en av disse kurvene for et gitt stoff.
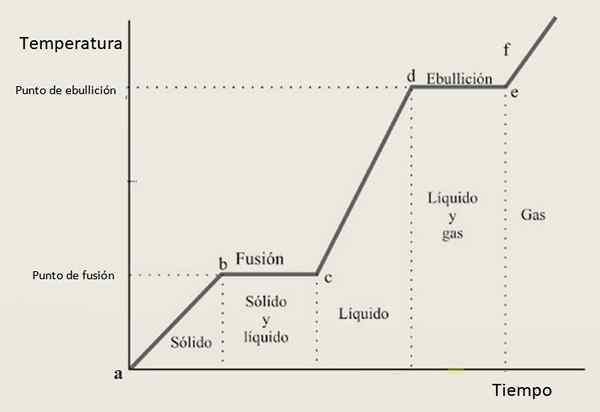 Figur 3. En varmekurve for et gitt stoff, med den typiske konfigurasjonen basert på trinn og skråninger.
Figur 3. En varmekurve for et gitt stoff, med den typiske konfigurasjonen basert på trinn og skråninger. Tolkning av varmekurven
I vekstintervaller AB, CD og Ef Stoffet finnes som henholdsvis fast, flytende og gass. I disse regionene øker kinetisk energi og med den temperaturen.
I mellomtiden i BC tilstanden fra fast til væske endrer seg, derfor sameksisterer de to fasene sameksistens. Dette er tilfelle i seksjonen av, der prøven går fra gassvæske. Her endrer den potensielle energien, og temperaturen forblir konstant.
Den omvendte prosedyren er også mulig, det vil si at prøven kan avkjøles slik at den vil ta i bruk andre stater. I dette tilfellet er det snakk om kjølekurve.
Oppvarmingskurver har det samme generelle aspektet for alle stoffer, selv om det selvfølgelig ikke er de samme numeriske verdiene. Noen stoffer krever mer tid enn andre for å endre tilstand, og smelte og fordampe ved forskjellige temperaturer.
Disse punktene er henholdsvis kjent som et smeltepunkt og kokepunkt, og er kjennetegn ved hvert stoff.
Kan tjene deg: flate speil: ligning, oppførsel, grafikkDet er grunnen til at varmekurvene er veldig nyttige, siden de indikerer den numeriske verdien av disse temperaturene for millioner av stoffer som eksisterer som faste stoffer og væsker i temperaturområdet som anses som normale og ved atmosfæretrykket.
Hvordan lages en varmekurve?
I prinsippet er det veldig enkelt: det er nok å plassere en substansprøve i en beholder utstyrt med en agitator, introdusere et termometer og varme jevnt.
Samtidig blir det i begynnelsen av prosedyren en stoppeklokke aktivert og de tilsvarende temperatur-tidsparene blir notert.
Varmekilden kan være en gass lighter, med god varmehastighet, eller en elektrisk motstand som når varme avgir varme, som kan kobles til en variabel kilde for å få forskjellige krefter.
For mer presisjon er det to teknikker som er mye brukt i kjemilaboratoriet:
- Differensiell termisk analyse.
- Differensiell feiende kalorimetri.
De sammenligner temperaturforskjellen mellom prøven som ble undersøkt og en annen referanseprøve med høy smeltetemperatur, nesten alltid et aluminiumoksyd. Disse metodene prøver å enkelt finne fusjons- og kokepunkter.
Eksempler (vann, jern ...)
Tenk på oppvarmingskurvene for vann og jern vist på figuren. Tidsskalaen vises ikke, men den er øyeblikkelig.
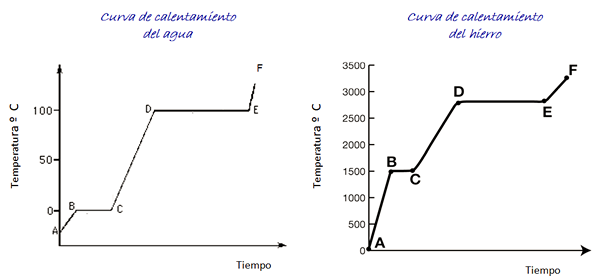 Figur 4. Vann- og jernoppvarmingskurver.
Figur 4. Vann- og jernoppvarmingskurver. Vann er et universelt stoff og temperaturområdet som er nødvendig for å se at det er lett å oppnå tilstandsendringer i laboratoriet. For jern er det nødvendig med mye høyere temperaturer, men som indikert ovenfor, endres ikke formen på grafen vesentlig.
Kan tjene deg: Steiner Theorem: Forklaring, applikasjoner, øvelserIssmelting
Når vi varmer isprøven, er vi i henhold til grafen på punkt A, ved en temperatur under 0º C. Det observeres at temperaturen øker med konstant hastighet til den når 0º C.
Vannmolekyler inne i isen vibrerer mer bredde. Når smeltetemperaturen (punkt B) er nådd, kan molekylene allerede bevege seg foran en annen.
Energien som kommer investeres i å redusere tiltrekningskraften mellom molekylene, så temperaturen mellom B og C forblir konstant til all is har smeltet.
Å gjøre vann til damp
Når vannet er helt i flytende tilstand, øker vibrasjonen av molekylene igjen og temperaturen øker raskt mellom C og D til kokepunktet med 100 ºC. Mellom D og E forblir temperaturen i den verdien mens energien som kommer er ansvarlig for alt vannet i beholderen for å fordampe.
Hvis all vanndamp er inneholdt i en beholder, kan den videreføres fra punkt E til punkt F, hvis grense ikke er vist i grafikken.
En jernprøve kan krysse de samme endringene. Imidlertid, gitt materialets natur, er temperaturområdene veldig forskjellige.
Referanser
- Atkins, p. Prinsipper for kjemi: oppdagelsesveiene. Pan -American Medical Editorial. 219-221.
- Chung, s. Oppvarmingskurver. Gjenopprettet fra: Chem.Librettexts.org.
- Oppvarmingskurver. Fusjonsvarme og fordampning. Gjenopprettet fra: wikipremed.com.
- Hewitt, Paul. 2012. Konseptuell fysisk vitenskap. 5. plass. Ed. Pearson. 174-180.
- University of Valladolid. Grad i kjemi, utvunnet fra: overnatting.drue.er.
- « Carnot Cycle Stages, applikasjoner, eksempler, øvelser
- Bromocresol grønne egenskaper, forberedelser, bruker »

