Diklormetanstruktur, egenskaper, bruksområder, toksisitet

- 2720
- 448
- Oliver Christiansen
Han diklormetan, Også kjent som metylenklorid, det er en organisk forbindelse hvis kjemiske formel er CH2Cl2. Spesifikt er det en alkylhalogenid avledet fra metangass. I motsetning til metan, er denne forbindelsen en fargeløs og polar væske.
Det ble opprinnelig syntetisert i 1839 av den franske kjemikeren og fysikeren Henri Victor Regnault (1810-1878), som klarte å isolere ham fra en blanding av klor og klormetan utsatt for sollys.
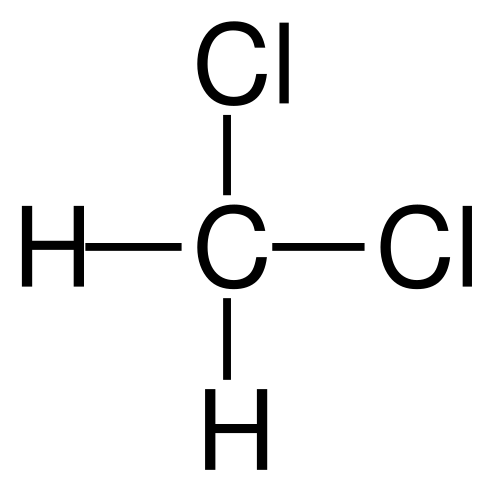 Strukturell formel av diklormetan. Kilde: Jü [Public Domain]
Strukturell formel av diklormetan. Kilde: Jü [Public Domain] Diklormetanen skjer industrielt ved behandling av metan eller klormetan med klorgass ved høy temperatur (400-500 ºC). Sammen med diklormetanen forekommer de i kloroformen og karbontetrakloridprosessen, som er atskilt ved destillasjon.
Diklormetanen brukes som et løsningsmiddel som tillater sveising av plastmaterialer og for å avfelle metaller. Det brukes også i kaffe og teafefin.
Diklormetan er en giftig forbindelse som kan produsere ved innånding irritasjon av neseborene og halsen. Leverskader er rapportert hos utsatte arbeidere for høye konsentrasjoner av diklormetan. I tillegg er han mutagent middel, og blir mistenkt for å være kreftfremkallende.
[TOC]
Struktur
 Molekylær struktur i diklormetan. Kilde: Gabriel Bolívar via Molview.
Molekylær struktur i diklormetan. Kilde: Gabriel Bolívar via Molview. I det første bildet ble den strukturelle formelen til CH vist2Cl2, der deres kovalente bindinger C-H og C-CL skiller seg ut. Opp og dens struktur representert av en modell av sfærer og barer. Legg merke til ved første øyekast at C-H-bindinger (hvite kuler) er korte, mens C-CL (grønne kuler) bindinger er lange.
Cho Geometry2Cl2 Det er tetraedralt; men forvrengt på grunn av de mest klumpete kloratomene. Den ene enden av tetrahedronen er definert av de to kloratomer, mer elektronegativ enn hydrogen og karbon. Derfor, i molekylet til CH2Cl2 Et permanent dipolmoment er etablert (1.6d).
Kan tjene deg: nøytraliseringsreaksjonDette gjør at diklormetanmolekyler kan samhandle med hverandre gjennom dipol-dipolo-krefter. På samme måte er disse intermolekylære interaksjonene ansvarlige for at denne forbindelsen skal eksistere som en væske til tross for dens lave molekylmasse; En væske som imidlertid er ganske flyktig.
Egenskaper
Utseende
Fargeløs væske.
Molmasse
84,93 g/mol.
Lukt
Søt, lik kloroform.
Lukt terskel
205 - 307 ppm.
Tetthet
1.3266 g/cm3 (20 ºC).
Smeltepunkt
- 97,6 ºC.
Kokepunkt
39,6 ºC.
Vannløselighet
25,6 g/l ved 15 ºC og 5,2 g/l a 60 ºC.
Diklormetanen er knapt løselig i vann. Mens begge molekyler, cho2Cl2 og h2Eller, de er polare, interaksjonene deres er muligens ineffektive på grunn av frastøtning mellom klor- og oksygenatomer.
Løselighet i andre løsningsmidler
Misnøye med etylacetat, alkohol, heksan, benzen, karbontetraklorid, diety eter, kloroform og dimetylformamid.
Oktanol/vannpartisjonskoeffisient
Logg P = 1.19.
Damptrykk
57,3 kPa (25 ºC). Dette trykket tilsvarer omtrent 5,66 atm, og reflekterer høyt damptrykk.
Damptetthet
2.93 i luftforhold tatt som 1.
Refraction Index (πd)
1.4244 (20 ºC).
Goo
0,413 cp (25 ºC).
tenningspunkt
Diklormetanen er ikke brannfarlig, men når den blandes med luften, danner den brennbare damper over 100 ºC.
Selvordemperatur
556 ºC.
Stabilitet
Det er stabilt ved omgivelsestemperatur i fravær av fuktighet, med en relativ stabilitet sammenlignet med dens kongener: karbontetrakloridkloroform og tetraklorid.
Det har en tendens til å karbonisere ved høye temperaturer (300-450 ºC), når damper kommer i kontakt med stål- og metallklorider.
Nedbrytning
Det kan brytes ned i kontakt med varme overflater eller en flamme, og avgir giftige og irriterende damper av fosgen og hydrogenklorid.
Kan tjene deg: DifferensialelektronKorrosjon
Diklormetanen angriper noen former for plast, gummi og belegg.
Fordampningsvarme
28,82 kJ/mol a 25 ºC.
Overflatespenning
28.20 dynas/cm ved 25 ºC.
Reaktivitet
Diklormetanen reagerer sterkt med aktive metaller, for eksempel kalium, natrium og litium. Reagerer med sterke baser, for eksempel kaliumbouthexide. Det er uforenlig med kaustiske stoffer, oksidanter og kjemisk aktive metaller.
I tillegg reagerer den med flytende oksygen i natrium- og kaliumlegeringer og nitrogen -tetroksyd. I kontakt med vann kan du kjøre noen rustfrie stål, nikkel, kobber, samt jern.
applikasjoner
De fleste bruksområder og anvendelser av diklormetan er basert på dens egenskaper som et løsningsmiddel. På grunn av denne egenskapen brukes diklormetanen i mat, transport, medisinproduksjonsindustri osv.
Matbehandling
Diklormetanen brukes i de koffeinerte kaffekorn og teblader. Det brukes også til utvinning av humle for øl, drikke og andre matflagg, samt for krydderbehandling.
Legemiddelindustrien
Diklormetan brukes til fremstilling av cephalosporin og ampicillin, i tillegg til fremstilling av antibiotika, steroider og vitaminer.
Fotografi
Det brukes også som et løsningsmiddel i produksjonen av cellulosetriacetat (CTA), brukt i opprettelsen av sikkerhetsfilmer.
Elektronisk industri
Det er en ideell forbindelse for produksjon av trykte kretsplater, ved bruk av aluminiumsoverflaten før du tilsetter platefotoret.
Maling
Diklormetanen er et løsningsmiddel som finnes i lakker og i malingsseparatorer, brukt til å eliminere lakk eller belegg av malerier av forskjellige typer overflater.
Transportere
Det tjener til å avfelle metalldeler og overflater som er til stede i jernbaneutstyr, så vel som i flymomponenter.
Kan tjene deg: destillert vannAndre bruksområder
Det brukes som et spray drivmiddel (aerosoler) og som et ekspansjonsmiddel for polyuretanskum. Det brukes også som en væske i noen typer julelys.
Toksisitet
Akutte effekter
Diklormetaninhalering kan forårsake irritasjon av de øvre luftveiene, hoste, tungpustethet eller mangel på luft.
Det kan produsere hud rødhet, og hvis forbindelsen forblir lang tid på den, forårsaker kjemisk forbrenning. I kontakt med øynene produserer diklormetanen en alvorlig irritasjon som kan omfatte en forbrenning.
I tillegg fungerer det som et nevrotoksin som genererer visuelle, auditive og psykomotoriske endringer; Men disse effektene er reversible for å opphøre innånding av diklormetan.
Kroniske effekter
Diklormetanen kan påvirke sentralnervesystemet og generere hodepine, mental forvirring, kvalme, oppkast og hukommelsestap.
Hos dyr gir det skadelige effekter på leveren, nyrene, sentralnervesystemet og kardiovaskulært system.
Så snart karsinogenese ikke har rapportert en betydelig økning i kreftdødsfall hos arbeidere utsatt for diklormetan. Imidlertid har dyreforsøk vist en økning som kan henføres til diklormetan i forekomsten av leverkreft og lunger, samt godartede svulster i brystkjertlene.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5ta Utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Nasjonalt senter for bioteknologiinformasjon. (2020). Diklormetan. PubChem -database., CID = 6344. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2020). Diklormetan. Hentet fra: i.Wikipedia.org
- Brumer. (14. juli 2018). Diklormetan. Gjenopprettet fra: Brumer.com
- MSDS online. (2019). Diklormetan (metylenklorid) farer og sikkerhetsinformasjon. Hentet fra: MSDSONline.com
- EPA. (2000). Metylenklorid (diklormetan). [PDF]. Gjenopprettet fra: EPA.Gov
- « Bestemmelse av aske metoder og eksempler
- Sør -Korea kulturtradisjoner, skikker, gastronomi, religion »

