Dimetylamin ((CH3) 2NH) struktur, egenskaper, bruksområder, risikoer
- 1515
- 86
- Prof. Joakim Johansen
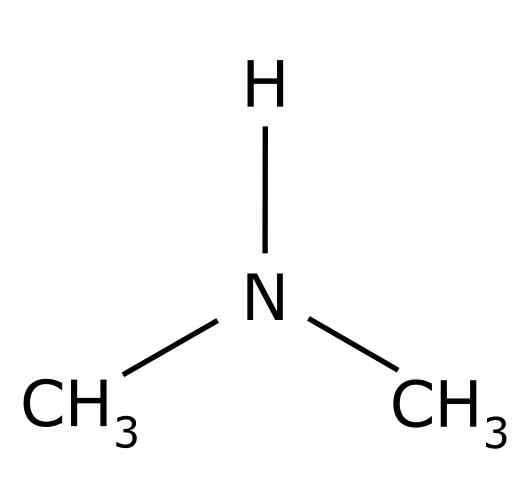
De Dimetylamin Det er en organisk forbindelse dannet av to metylgrupper -3 Forent til en -nh -gruppe. Den kjemiske formelen er (Cho3)2NH. Det er en fargeløs gass. Når en lukt av fisk oppfattes i luften ved lave konsentrasjoner. Imidlertid, hvis det er i høy konsentrasjon, har den en lukt av ammoniakk NH3.
Dimetylamin er til stede i planter og dyr. Det antas at hos mennesket kommer fra nedbrytningen av visse enzymer, men også fra inntak av noen matvarer som fisk. Hvis dimetylamingass oppløses i vann, danner den veldig alkaliske og etsende løsninger.
 Dimetylamin. Ring0 [Public Domain]. Kilde: Wikimedia Commons.
Dimetylamin. Ring0 [Public Domain]. Kilde: Wikimedia Commons. Den har forskjellige industrielle bruksområder som å produsere løsningsmidler, for å akselerere vulkaniseringen av gummi.
Dimetilamin er en veldig brennbar gass. Containerne som inneholder den skal ikke utsettes for varme eller brann, da de kan utnytte. I tillegg er deres damper irriterende øyne, hud- og luftveisanalen.
Det er en forbindelse som kan være en del av atmosfæriske aerosoler, det vil si av veldig tynne dråper som finnes i atmosfæren.
[TOC]
Struktur
Dimetilamin er en sekundær alifatisk amin. Dette betyr at nitrogensubstituenter (N) er alifatiske (-CH3), som betyr at de ikke er aromatiske, og at de er to. Derfor er det to metyl -ch3 United Nitrogen, som også har et hydrogen (H).
I dimetylaminmolekylet har nitrogen (N) et par gratis elektroner, det vil si et par elektroner som ikke er forent til noe annet atom.
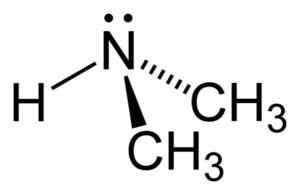 Struktur av dimetylamin. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Struktur av dimetylamin. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Nomenklatur
- Dimetylamin
- N, N-dimetylamin
- N-metylmetanamin
- DMA (akronym for di-metyl-amin).
Egenskaper
Fysisk tilstand
Fargeløs gass.
Molekylær vekt
45,08 g/mol
Smeltepunkt
-93 ºC
Kokepunkt
7.3 ºC
Flashpoint
-6.69 ºC (lukket koppmetode).
Selvordemperatur
400 ° C
Kan tjene deg: lov med flere proporsjonerTetthet
Væske = 0,6804 g/cm3 A 0 ºC.
Damp = 1,6 (relativ tetthet med hensyn til luft, luft = 1).
Løselighet
Veldig løselig i vann: 163 g/100 g vann ved 40 ° C. Løselig i etanol og etyleter.
Ph
Vandige dimetylaminløsninger er sterkt alkalisk.
Dissosiasjonskonstant
Kb = 5,4 x 10-4
Pktil av konjugert syre = 10 732 til 25 ° C. Konjugatsyre er dimetylamoniumion: (Cho3) NH2+
Kjemiske egenskaper
Flytende dimetylamin kan angripe noen plast, dekk og belegg.
Når du oppløses i vann, tar nitrogenfri elektronpar (N) et proton (h+) vann, etterlater en åh gratis-, Så det danner veldig alkaliske og etsende løsninger:
Dimetylamin + vann → Dimetylamoniumion + hydroksylion
(Ch3)2NH + H2O → (velg3)2NH2+ + Åh-
Med salpetersyre oppnås et nitratsalt, det vil si dimetyla amotylamoniumnitrat:
Dimetylamin + salpetersyre → Dimetylamoniumnitrat
(Ch3)2NH +HNO3 → (kap3)2NH2+NEI3-
Andre egenskaper
Når i lav luftkonsentrasjon har en lukt som ligner fisk, mens det i høye konsentrasjoner lukter ammoniakk (NH3).
Biokjemiske reaksjoner
I organismen kan dimetylamin lide nitrillær under svakt sure forhold for å gi dimetylnitrosamin en karsinogenforbindelse (CH3)2N-nei.
Dimetlnitrosamindannelse skjer fra dimetylamin og nitritt (natriumnitritt) i magen (en pH 5-6) ved handling av bakteriene som eksisterer i mage-tarmkanalen. Natriumnitritt er til stede i noen matvarer.
Dimetylamin + natriumnitritt → Dimetylnitrosamin + natriumhydroksyd
(Ch3)2NH + Nano2 → (kap3)2N-No + NaOH
Å skaffe
Dimetilamin tilberedes kommersielt ved å reagere metanol (velg3Å) med ammoniakk (NH3) ved 350-450 ° C i nærvær av en silika-aluminiumoksydkatalysator (SIO2/Til2ENTEN3).
2 Ch3OH + NH3 → (kap3)2NH + 2 H2ENTEN
Siden det produseres monometylamin og trimetylamin, utføres en rensing i en serie på fire til fem destillasjonskolonner.
Tilstedeværelse i naturen
Dimetylamin finnes i planter og dyr. Det er også til stede naturlig og rikelig i menneskelig urin.
Det kan tjene deg: Epoksyd: nomenklatur, innhenting, applikasjoner, eksemplerDet anslås at dens tilstedeværelse hos mennesker skyldes at visse typer tarmbakterier produseres fra noen forbindelser som finnes i mat.
Noen av disse forbindelsene er bakken (forbindelsen som er assosiert med vitamingruppen B) og trimetylaminoksid. Det antas også at det kommer fra en enzymhemmer av nitrogenoksid (NO) som dannes i kroppen.
Enkelte informasjonskilder indikerer at økningen i dimetylamin i urinen er forårsaket av inntak av fisk og frukt av havet, der hovedverdiene oppnås når de spiser blekksprut, kapper, sardiner, sverdfisk, torsk, fisk og linje.
 Å spise fisk kan øke dimetylaminnivået i urin. Forfatter: Anna Sulencha. Kilde: Pixabay.
Å spise fisk kan øke dimetylaminnivået i urin. Forfatter: Anna Sulencha. Kilde: Pixabay. Pasienter med overflødig dimetylamin
Det anses at dimetylamin er et uremisk toksin, det vil si et stoff som kan forårsake skade hvis konsentrasjonen i urin blir hevet. Faktisk er det observert veldig høye nivåer av dimetylamin hos pasienter med nyresykdom på terminalstadiet.
Det antas at det hos disse pasientene kan være overbefolkning av tarmbakterier som kan produsere den.
applikasjoner
DMA eller DMA brukes til:
- Forberedelse av andre forbindelser.
- Produksjon av dimetylformamid og dimetylacetamidløsningsmidler.
- Akselerere vulkaniseringen av visse tannkjøtt.
- Fjern hårhår under soling.
- Fungere som en antioksidant for løsningsmidler.
- Tjene som et mineralflotasjonsmiddel.
- Hemmer korrosjon og som et anti -Sniff -middel.
- Funksjon som overflateaktivt middel.
- Lage såper og vaskemidler.
- Fungere som kjemiker i tekstiler.
- Funksjon som et anti -dateringsmiddel i drivstoff og som en gassstabilisator.
- Forbered fargestoffer.
- Absorbere syregasser.
- Server som plantevernmidler og raketter.
- Være en del av midlene for vannbehandling.
- Fungere som et soppmiddel i agrokjemiske produkter.
- Allerede avviklet bruksområder som å tiltrekke og utrydde gorgjos eller insekter som angriper bomull.
 Bomullsplante. Forfatter: Isaa KC. Kilde: Pixabay.
Bomullsplante. Forfatter: Isaa KC. Kilde: Pixabay.  Tidligere ble insektene som angriper bomullsplanter eliminert med dimetylamin. Marvinbikolano [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Tidligere ble insektene som angriper bomullsplanter eliminert med dimetylamin. Marvinbikolano [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Risiko
Dimetilamindamp er irriterende hud, øyne og luftveier.
Kan tjene deg: uorganiske forbindelserHvis du kommer i kontakt med huden i flytende form, kan det forårsake frysing og kjemisk forbrenning. Innånding har skadelige helseeffekter.
DMA -gass er etsende og kan danne etsende vandige oppløsninger. De vandige oppløsningene dine kan bli brennbare med mindre de er ganske utvannet.
Gass -formet dimetylamin er lett betent ved å produsere giftige røyk av nitrogenoksider (neix).
Hvis beholderen som inneholder denne gassen blir utsatt for intens varme eller varme, kan den eksplodere.
Påvirkning av DMA i atmosfæren
Atmosfærisk aerosol (veldig små dråper blanding av naturlige forbindelser og/eller miljøgifter i atmosfæren) har en dyp innvirkning på globalt klima og luftkvalitet i de forskjellige regionene i verden.
Dannelsen av nye aerosolpartikler er ennå ikke helt forstått.
Det anslås at dimetylamin deltar sammen med andre forbindelser i dannelsen av disse partiklene, som ser ut til å avhenge av området med sterke DMA -utslipp.
For eksempel i industriområder er det større konsentrasjon enn i landbruksområder, og dette kan påvirke måten DMA deltar.
Det skal bemerkes at ifølge noen forskere kan forbrenning av plantemateriale som inneholder glyfosat (et av ugressmidlene som er mest brukt i verden) føre til dannelse av dimetylamin.
 Atmosfæriske aerosoler på Sør -Amerika. Dimetilamin kan bidra til dannelsen. Marvinbikolano [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Atmosfæriske aerosoler på Sør -Amerika. Dimetilamin kan bidra til dannelsen. Marvinbikolano [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Referanser
- ELLER.S. National Library of Medicine. (2019). Dimetylamin. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Morrison, r.T. og Boyd, r.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- WINDHOLZ, m. et al. (redaktører) (1983). Merck -indeksen. En enyclopedia av kjemikalier, medisiner og biologisk. Tiende utgave. Merck & co., Inc.
- ABRAMOWITZ, m.K. et al. (2010). Patofysiologien til uremi. Alifatiske aminer. Ved kronisk nyresykdom, dialyse og transplantasjon (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Li, h. et al. (2019). Påvirkning av atmosfæriske forhold på svovelsyre-dimetylamin-ammonia-basert ny partikkeldannelse. Chospher 2019; 245: 125554. NCBI kom seg.NLM.NIH.Gov.
- Mackie, J.C. og Kennedy, og.M. (2019). Pyrolyse av Glyphosate og Songs giftige produkter. Miljø. Sci. TECHNOL. 2019: 53 (23): 13742-13747. NCBI kom seg.NLM.NIH.Gov.

