Kjemiske ligningsdeler og eksempler
- 3624
- 986
- Prof. Theodor Gran
De Kjemisk ligning Det er en skjematisk fremstilling av noen av egenskapene til en kjemisk reaksjon. Det kan også sies at den kjemiske ligningen beskriver endringene av de forskjellige stoffene som er involvert i en reaksjon.
I den kjemiske ligningen plasseres formlene og symbolene på de forskjellige deltakende stoffene, og peker tydelig antall atomer i hvert element som er til stede i forbindelsene, som vises som et abonnement og ikke kan endres når du balanserer ligningen.
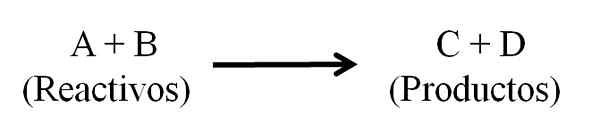
 Generell kjemisk ligning for en kjemisk reaksjon. Reagenser og produkter. Kilde: Gabriel Bolívar.
Generell kjemisk ligning for en kjemisk reaksjon. Reagenser og produkter. Kilde: Gabriel Bolívar. Den kjemiske ligningen må vises balansert, det vil si antall atomer av både reagenser og produkter må være det samme. På denne måten blir loven om bevaring av materie overholdt. Det er ønskelig at tallene som brukes til å balansere ligningene er hele tall.
Disse ligningene avslører ikke påfølgende trinn, eller hvorfor mekanismer reagenser blir omdannet til produkter.
Det er grunnen til at selv om de er veldig nyttige for å forstå hvor en kjemisk reaksjon går, tillater den ikke å forstå dens molekylære aspekter eller hvordan de påvirkes av visse variabler; som pH, viskositet, reaksjonstid, agitasjonshastighet, blant andre.
[TOC]
Deler av en kjemisk ligning
I utgangspunktet er det tre hoveddeler i en kjemisk ligning: reagensene, produktene og pilen som indikerer betydningen av den kjemiske reaksjonen.
Plassering av reagenser og produkter
I den kjemiske ligningen fungerer alle stoffer som fungerer som reagenser og alle de som er produkter, vises. Disse stoffgruppene er atskilt med en pil som indikerer betydningen av reaksjonen. Reagensene er plassert til venstre for pilen og produktene til høyre.
Pilen betyr det som produseres og er orientert fra venstre til høyre (→), selv om det i de reversible reaksjonene er to ekvivalente og parallelle piler; en rettet til høyre, og en annen til venstre. Symbolet (Δ) er vanligvis plassert på pilen, noe som indikerer at varme ble brukt i reaksjonen.
Kan tjene deg: terpenosI tillegg er identifiseringen av katalysatoren vanligvis plassert på pilen, hvis mulig med sin formel eller symbol. De forskjellige stoffene som vises som reagenser er atskilt med tegn (+), noe som indikerer at stoffer reagerer eller kombineres med hverandre.
Når det gjelder stoffer som vises som produkter, har ikke tegn (+) den tidligere konnotasjonen; Med mindre reaksjonen er reversibel. Det er praktisk at tegnet (+) er plassert like fra stoffene som skiller.
Balanse av kjemiske ligninger
Det er et essensielt krav at kjemiske ligninger er riktig balansert. For dette plasseres et tall som kalles støkiometrisk koeffisient. Når det er nødvendig, må denne koeffisienten gå foran stoffene som vises som reagenser eller produkter.
Dette er for å sikre at antallet av alle atomer i elementene som vises som reagenser er nøyaktig lik antallet av dem som vises i produktet. Den enkleste kjemiske ligningsmetoden er Tanteo.
Fysiske tilstander av komponentene i den kjemiske ligningen
I noen kjemiske ligninger er den fysiske tilstanden til stoffer indikert med en sub -industry. For dette brukes følgende forkortelser på spansk: (er) for fast tilstand; (l) for flytende tilstand; (g), gassformig tilstand; og (ac), vandig løsning.
Eksempel: Kalsiumkarbonatreaksjon med saltsyre.
Tyv3 (s) + 2 HCl(AC) → CACL2 (s) + H2ENTEN(L) + Co2 g)
Endringer av fysisk status
I noen tilfeller er det indikert i den kjemiske ligningen hvis det er en produksjon av en gass i den kjemiske reaksjonen, eller hvis det er nedbør av noen av stoffene som produseres.
Kan tjene deg: binære salterTilstedeværelsen av en gass er indikert med en vertikal pil med sin ende rettet oppover (↑), plassert på høyre side av gassformet stoffet.
Eksempel: sinkreaksjon med saltsyre.
Zn +2 HCl → Zncl2 + H2↑
Hvis det i den kjemiske reaksjonen danner et av stoffene et bunnfall, symboliseres dette ved å plassere en vertikal pil med dens ende rettet ned (↓), plassert på høyre side av det utfelte stoffet.
Eksempel: saltsyreaksjon med sølvnitrat.
HCl + Agno3 → HNO3 + AGCL ↓
Eksempel på kjemiske ligninger
- Fotosyntese
 Fotosyntese ligning
Fotosyntese ligning Fotosyntese er en prosess der planter fanger og transformerer lysenergi, fra sollys, for å generere energien som er nødvendig for deres livsopphold. Fotosyntese utføres av organeller som er typiske for planteceller som kalles kloroplaster.
I kloroplastmembranen er tilacoider, steder der klorofyllene er funnet til og b, som er hovedpigmentene som fanger lysenergi.
Mens fotosyntese er en kompleks prosess, kan den skjematiseres i følgende kjemiske ligning:
6 co2 + 6 timer2O → c6H12ENTEN6 + 6 o2↑ Δgº = 2.870 kJ/mol
C6H12ENTEN6 Det er formelen for glukose, metabolisert karbohydrat for produksjon av ATP; Forbindelse som er det viktigste energireservoaret i de fleste levende vesener. I tillegg genereres fra glukose NADPH, koenzym som trengs for mange reaksjoner.
- Cellulær pust
Celler bruker oksygen for metabolisme av mange stoffer som er til stede i inntatt mat. I mellomtiden brukes ATP som en energikilde til aktivitetene utført av levende vesener, og produserer i disse prosessene dioksidkarbon og vann.
Kan tjene deg: aluminiumacetat (AL (CH3COO) 3): Struktur, egenskaper, brukHvis glukose brukes som en metabolisert stoffmodell, kan pust skjemaes med følgende kjemiske ligning:
C6H12ENTEN6 + 6 o2 → 6 co2 + 6 timer2ENTEN
- Vanlige elementers reaksjoner
Nedbrytningsreaksjon
En forbindelse eller forbindelser dissosierer (n) som dannes med sine atomer andre forskjellige forbindelser:
2 Kclo3 (s) → 2 KCl(S) + 3 o2 g)
Forskyvningsreaksjon
Et metall reagerer med en forbindelse som erstatter en metall til stede i dette:
Mg(S) + Cuso4 (AC) → Cu(S) + MGSO4 (AC)
Eliminasjonsreaksjon
I denne typen reaksjoner, antall atomer eller grupper festet til et karbonatom:
Ch3-Ch2Br +NaOH → H2C = Ch2 + H2O +NABR
Hydreringsreaksjon
Det er en reaksjon der en forbindelse tilfører et vannmolekyl. Denne reaksjonen er viktig i fremstillingen av alkoholer:
H2C = Ch2 + H2O → h2C-CH2Åh
Nøytraliseringsreaksjon
En base eller alkali reagerer med en syre som produserer et salt og vann:
HCl(AC) + Naoh(AC) → NaCl(AC) + H2ENTEN(L)
Synteseaksjon
I denne typen reaksjoner kombineres to eller flere stoffer for å forårsake en ny forbindelse:
2 li(S) + Cl2 g) → 2 LiCl(S)
Dobbelt forskyvningsreaksjon (metatese)
I denne typen reaksjoner er det utveksling av positive og negative ioner for å danne nye forbindelser:
Agno3 (AC) + NaCl(AC) → Agcl(S) + Eldre bror3 (AC)
Referanser
- Blomster, j. (2002). Kjemi. Utgave 1var. Santillana redaksjon
- Mathews, c. K., Van Holde, K. OG., Og Ahern, K. G. (2002). Biokjemi. 3var Utgave. Pearson Addison Wesley redaksjon
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2019). Kjemisk ligning. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (20. september 2019). Hva er en kjemisk ligning? Gjenopprettet fra: Thoughtco.com
- « Molært volumkonsept og formel, beregning og eksempler
- Challenger Abyss geologisk formasjon, beliggenhet, egenskaper »

