Differensialelektron

- 1200
- 303
- Mathias Aas
Han Differensialelektron o Differensierer er det siste elektronet som er plassert i sekvensen av den elektroniske konfigurasjonen av et atom. Hva heter du? For å svare på dette spørsmålet er det nødvendig å kjenne den grunnleggende strukturen til et atom: dets kjerne, tomrommet og elektronene.
Kjernen er et tett og kompakt aggregat av positive partikler som kalles protoner, og nøytrale partikler som kalles nøytroner. Protonene definerer atomnummeret Z og utgjør sammen med nøytronene atommassen sammen med atommassen. Imidlertid kan et atom ikke bare bære positive ladninger; Derfor baner elektronene rundt kjernen for å nøytralisere den.
 Grunnleggende atomstruktur: Hoved subatomiske partikler
Grunnleggende atomstruktur: Hoved subatomiske partikler For hvert proton som tilfører kjernen, blir et nytt elektron innlemmet i orbitaler for å motvirke den økende positive ladningen. På denne måten er det nye ekstra elektronet, differensialelektronet, nært knyttet til atomnummeret z.
Differensialelektronet finnes i det ytterste elektroniske laget: Valencia -laget. Derfor, jo lenger kjernen er, jo større er energien som er forbundet med den. Denne energien er ansvarlig for sin deltakelse, så vel som for resten av Valencia -elektronene, i de kjemiske reaksjonene som er karakteristisk for elementene.
[TOC]
Kvantetall
I tillegg til resten av elektronene, kan differensialelektronet identifiseres med dets fire kvantetall. Men hva er kvantetallene? De er "n", "l", "m" og "s".
Kvantetallet "n" betegner størrelsen på atom- og energinivået (k, l, m, n, eller, p, q). "L" er det sekundære eller acemutale kvantetallet, som indikerer formen på atombanene, og tar verdier på 0, 1, 2 og 3 for orbitalene "S", "P", "D" og "F ", henholdsvis.
Det kan tjene deg: Aforert kolbe: Kjennetegn, hva er det for, typer, bruker"M" er det magnetiske kvantetallet og indikerer den romlige orienteringen av orbitalene under et magnetfelt. Dermed 0 for orbital "s"; -1, 0, +1, for orbital "P"; -2, -1, 0, +1, +2, for orbital “d”; og -3, -2, -1, 0, +1, +2, +3, for orbital “F”. Til slutt kvantetallet av spinn “s” (+1/2 for ↑ og -1/2 for ↓).
Derfor har et differensialelektron assosiert de tidligere kvantetallene ("n", "l", "m", "s"). Fordi den motvirker den nye positive belastningen som genereres av den ekstra protonen, gir den også atomnummeret Z for elementet.
Hvordan kjenne differensialelektronet?
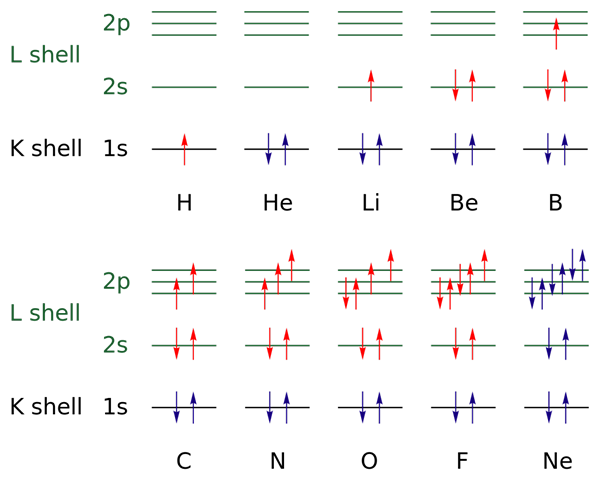
I det øvre bildet er elektroniske konfigurasjoner representert for elementene fra hydrogen til neongass (H → NE).
I dette er elektronene til de åpne lagene indikert med fargen rød, mens de i de lukkede lagene er indikert med fargen blå. Lagene refererer til kvantetallet "n", det første av de fire.
På denne måten tilfører Valencia -konfigurasjonen av H (↑ Rød) et annet elektron med motsatt orientering for å bli den fra HE (↓ ↑, begge blått fordi nå er nivå 1 stengt). Dette tilsatte elektronet er da differensialelektronet.
Dermed kan det observeres hvordan differensialelektronet tilfører valenslaget (røde piler) fra elementene, og skiller dem fra hverandre. Elektronene fyller orbitalene som respekterer vaskeregelen og Paulings eksklusjonsprinsipp (perfekt observert fra B til NE).
Og hva med kvantetall? Disse definerer hver pil - det vil si at hver elektron - og dens verdier kan bekreftes med den elektroniske konfigurasjonen for å vite om de til differensialelektronet er eller ikke eller ikke.
Det kan tjene deg: Hva er de negative effektene vi har med vannløselighet?Eksempler på differensielle elektroner i flere elementer
Klor
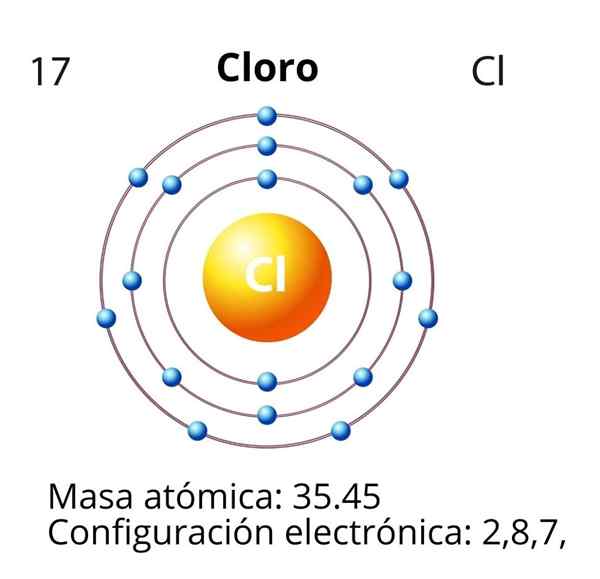
I tilfelle av klor (CL) er atomnummeret Z lik 17. Den elektroniske konfigurasjonen er da 1s22s2sp63s23p5. Orbitaler merket i rødt tilsvarer de fra Valencia -laget, som presenterer nivå 3 åpne.
Differensialelektronet er det siste elektronet som er plassert i den elektroniske konfigurasjonen, og kloratomet er den for 3P -orbitalen, hvis disposisjon er som følger:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Respekterer vaskeregelen, 3P -orbitalene er først fylt med like energi (en pil oppover i hver bane). For det andre parrer de andre elektronene med ensomme venstre til høyre elektroner. Differensialelektronet er representert i en grønn ramme.
Dermed har differensialelektronet for klor følgende kvantetall: (3, 1, 0, -1/2). Det vil si "n" er 3; "L" er 1, orbital "P"; "M" er 0, fordi det er orbital "P" av mediet; Og "S" er -1/2, siden pilen peker ned.
Magnesium
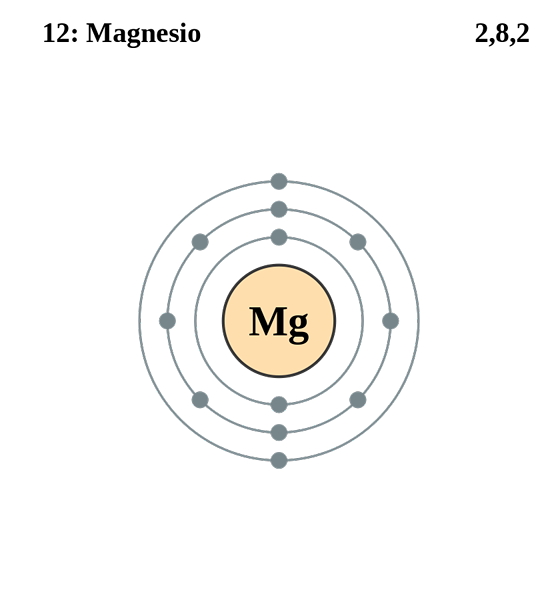 Elektronisk magnesiumkonfigurasjon. Kilde: elektron_shell_012_magnesium.SVG: Pumbaa (originalt arbeid av Greg Robson) Derivatarbeid: Kizar, CC BY-SA 3.0, via Wikimedia Commons
Elektronisk magnesiumkonfigurasjon. Kilde: elektron_shell_012_magnesium.SVG: Pumbaa (originalt arbeid av Greg Robson) Derivatarbeid: Kizar, CC BY-SA 3.0, via Wikimedia Commons Den elektroniske konfigurasjonen for magnesiumatom er 1s22s2sp63s2, Som representerer orbital og dets Valencia -elektron på samme måte:
↑ ↓
3s
0
Denne gangen har differensialelektronet kvantetall 3, 0, 0, -1/2. Den eneste forskjellen i dette tilfellet med hensyn til klor er at kvantetallet "L" er 0 fordi elektronet opptar en orbital "S" (3S).
Zirconio
Den elektroniske konfigurasjonen for zirkoniumatom (overgangsmetall) er 1s22s2sp63s23p64s23d104p65s24d2. På samme måte som de tidligere tilfellene, er representasjonen av orbitalene og elektronene i Valencia som følger:
Det kan tjene deg: Cyclopentano (C5H10): Struktur, egenskaper og bruk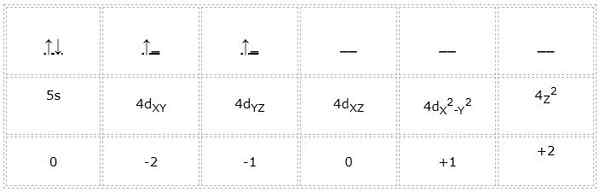
Dermed er kvantetallene for differensialelektronet merket i grønt: 4, 2, -1, +1/2. Her, som elektronet opptar den andre orbitalen "D", har det et kvantetall "m" lik -1. Fordi pilen peker opp, er spinnnummeret "S" lik +1/2.
Ukjent element
Kvantumallene til differensialelektronet for et ukjent element er 3, 2, +2, -1/2. Hva er atomnummeret Z for elementet? Å vite Z kan tyde hva elementet er.
Denne gangen, ettersom "n" er den samme 3, betyr det at elementet er i den tredje perioden av det periodiske tabellen, med "d" orbitaler som Valencia Layer ("L" lik 2). Derfor er orbitaler representert som i forrige eksempel:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Kvantetall.
Dermed har elementet som søkes 3D -orbitaler10 full, som de indre elektroniske lagene. Avslutningsvis er elementet metall sink (Zn).
Imidlertid kan ikke kvantumnumrene til differensialelektronet skille mellom sink og kobber, fordi dette siste elementet også presenterer 3D -orbitaler fullt. Fordi? Fordi kobber er et metall som mislykkes med reglene for fylt med elektroner av kvante årsaker.
Referanser
- Jim Branson. (2013). Sinks regler. Hentet fra QuantumMechanics.UCSD.Edu
- Foredrag 27: Sinks regler. Gjenopprettet fra pH.QMUL.Ac.Storbritannia
- Purdue University. Kvantetall og elektronkonfigurasjoner. Hentet fra Murmed.Chem.Purdue.Edu
- Salvat Encyclopedia of Science. (1968). Salvat Physics, S.TIL. av Pamplona-utgaver, bind 12, Spania, s. 314-322.
- Walter J. Moore. (1963). Fysisk kjemi. I Partikler og bølger. Fjerde utgave, Longmans.

