Calomel elektrodeoperasjon, egenskaper, bruk

- 4354
- 158
- Dr. Andreas Hopland
Han Calomel elektrode O Calomelanes er en sekundær elektrode som gjør det mulig2Cl2, tidligere kjent som Calomel. Både reagenser, HG og HG2Cl2, De vinner eller mister elektroner avhengig av mediet som elektroden er nedsenket.
Normalt forkortet som EC erstatter denne elektroden i mange målinger til standard hydrogenelektrode (hun), siden det er lettere å bygge, og mindre risikabelt å manipulere (til tross for at han har kvikksølv). Inni inneholder den en KCL -løsning som et elektrolytisk medium for elektronstrømning.
 Calomel elektrode i full måling. Kilde: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Calomel elektrode i full måling. Kilde: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons Calomelelektrode kan ha forskjellige varianter avhengig av størrelse, eller viktigere, av KCL -konsentrasjonen. Når KCL -løsningen er mettet, snakker vi om en elektro fra Saturado Calomel (ESC). ESC er lettere å forberede enn EF, men mer følsom for temperaturendringer.
Bruken av denne elektroden har tillatt å bestemme halvlivspotensialene for utallige redoksreaksjoner. Det er også en tilbakevendende enhet i potensiometriske bestemmelser, som søker å kjenne mengden analyt avhengig av cellen og målte potensial.
[TOC]
Fungerer
Slik at Calomels elektrode fungerer, Hg-HG-paret2Cl2 Du må reagere, enten du vinner eller mister elektroner.
Katodisk
Når reduksjonen eller forsterkningen av elektroner oppstår inne i calomelelektroden, har vi følgende reaksjoner:
Hg2Cl2 → Hg22+ + 2cl- (Ionisering)
Hg22+ + 2e- → 2HG (reduksjon)
Hg2Cl2 + 2e- → 2Hg +2Cl- (Netto reaksjon)
Kan tjene deg: eksoterm reaksjonDerfor HG2Cl2 Vinn elektroner som reduserer til metallisk kvikksølv.
Potensialet E av elektroden når reduksjonen oppstår er gitt av ligningen:
E = eº - 0.0591 log [CL-]
Der det observeres at det utelukkende avhenger av konsentrasjonen av CL -ionene-, Å være standard reduksjonspotensial for denne målte elektroden foran standard hydrogenelektrode.
Anodisk
Innenfor elektroden kan en oksidasjonsprosess også skje:
2HG → Hg22+ + 2e- (Oksidasjon)
Hg22+ + 2cl- → Hg2Cl2 (Nedbør)
2hg +2cl- → Hg2Cl2 + 2e- (Netto reaksjon)
Det vil si at kvikksølv oksiderer for å generere mer HG2Cl2.
Potensialet E i dette tilfellet er gitt av:
E = eº + 0.0591 log [CL-]
Og igjen, og det kommer an på [CL-].
Generell reaksjon
Den generelle reaksjonen for Calomels elektrode er:
Hg2Cl2(S) + 2e- ⇌ 2Hg (L) + 2Cl-
Følelsen av balanse vil avhenge av mediet der elektroden er i kontakt. CL- Bestem løseligheten til HG2Cl2, som igjen har innvirkning på dannelsen eller oksidasjon av HG.
Og potensialet som er bestemt for en spesifisert konsentrasjon av CL -ioner- Det vil være lik:
OGCalomel = ENett - OGokse
Å være eCalomel Potensialet som rapporteres som en referanse i visse potensielle tabeller.
Kjennetegn på calomelelektroden
Representasjon av semi
Calomel Electrode Semi -eed kan representeres som følger:
Pt | Hg | Hg2Cl2| Cl- (XM)
Der bare konsentrasjonen av CL -ioner er viktig-, uttrykt i molaritet eller normalitet. Den potensielle E av elektroden vil variere hvis den er fylt med løsninger av forskjellige KCL -konsentrasjoner.
For eksempel en EC med KCl 0.1 m har en og lik 0.3356 V ved 25 ° C; Mens ESC, med mettet KCl, har en og lik 0.2444 V ved samme temperatur.
Kan tjene deg: isopentano: struktur, egenskaper, bruk, skaffelseDerfor er KCL -konsentrasjonen den viktigste egenskapen til kalomelelektroder, da den vil indikere hva du skal bruke når beregningene av potensiometriske målinger utføres.
Kommersielt oppnås tre typer calomelelektroder: mettet (esc), det nittende (0.1 n eller 0.1 m kcl) og normalen (1 n eller 1 m kcl). En elektrode av Calomel 1 M KCl ville bli representert som:
Pt | Hg | Hg2Cl2| Cl- (1 m)
Fester
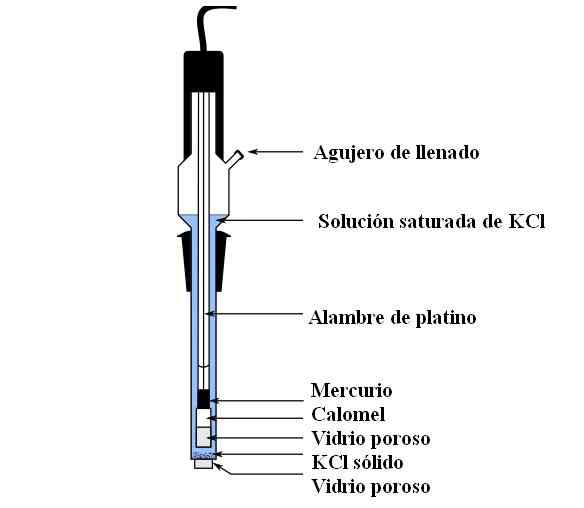 Calomel elektrodedeler. Kilde: Bachi-Bouzou, CC0, via Wikimedia Commons
Calomel elektrodedeler. Kilde: Bachi-Bouzou, CC0, via Wikimedia Commons I det øvre bildet viser vi hoveddelene av en vanlig kalomelelektrode. Den er laget av glass, og består av to containere: en ekstern en, som settes i elektrokjemisk kontakt med mediet til målingene og inneholder KCL -løsningen; Og en indre, der Hg-Hg-blandingen hviler2Cl2.
Internt inneholder calomelelektroden flytende kvikksølv, som en Hg -pasta blir festet2Cl2 fuktet med kvikksølv. Dette er den mest aktive fasen av elektroden. Det porøse glasset brukes til å tillate bare inntreden eller utkjøring av CL -ionene-, Men ikke HGs krystaller2Cl2 eller kvikksølvdråper.
En platinakabel, der elektronene strømmer, er nedsenket i kvikksølv, og er ansvarlig for å koble elektroden med voltmeteret og den eksterne kretsen det gjelder.
Gjennom fyllingshullet helles KCL -løsningen, som inneholder avvikling av salt oppløst. I mellomtiden, i bunnen av elektroden, har vi en veldig liten åpning i et porøst glass, som kommer i direkte kontakt med målingsmediet. Hensikten med det porøse glasset er å tillate kontakt uten uønskede utvekslinger av stoffer som forurenser elektroden eller prøven.
Det kan tjene deg: Cyclohexen: Struktur, egenskaper, syntese og brukFordeler
Calomel -elektroden presenterer følgende fordeler med hensyn til standard hydrogenelektrode:
-Lett å bygge og manipulere
-Cellepotensialet forblir konstant selv om vannet fordamper
-Du trenger ikke en saltbro
ESC er den enkleste å bygge fra calomelelektroder, da KCl er nok til å løse seg opp til krystallene deres er dannet. Da vil løsningen være mettet og klar til å kaste inne i elektroden.
Ulemper
Calomels elektrode presenterer imidlertid følgende ulemper:
-Ved å inneholde flytende kvikksølv, kan det utøve en negativ innvirkning på miljøet
-Det kan ikke brukes til kvantitative analyser i prøver med en temperatur større enn 60 ºC, siden HG2Cl2 begynner å bryte sammen, noe som får elektrodeavlesninger til å mislykkes
ESC har også den ulempen at den er veldig følsom for temperaturendringer.
Silver Silver Electrode har erstattet Calomel i mange av potensiometriske bestemmelser.
applikasjoner
Calomels elektrode er en av de mange elektrodene som brukes daglig i potensiometriske bestemmelser, slik.
Calomel -elektroden brukes også i pH -målinger og syklisk voltmetri.
Referanser
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kjemi (Femte utg.). Pearson Prentice Hall.
- Wikipedia. (2020). Mettet kalomellelektrode. Hentet fra: i.Wikipedia.org
- Generalic, eni. (20. oktober 2018). Elektrode calomel. Croatian-England Chemistry Dictionary & Glossary. KTF-Split. 30. oktober. 2020. Gjenopprettet fra: Ordliste.Periodni.com
- Skoog d.TIL., Vest d.M. (1986). Instrumental analyse. (Second Ed.). Inter -amerikansk., Mexico.
- Hills, g., Ives, d. T. (1950). Calomel -elektroden. Natur 165, 530 doi.org/10.1038/165530A0
- JMGAV. (9. desember 2012). Potentiometri (II): Elektroder. Hentet fra: Triplenlace.com
- « Sosio -kritiske paradigmeegenskaper, metoder, representanter
- Potentiometry Fundamentals, ligninger, elektroder »

