Potentiometry Fundamentals, ligninger, elektroder

- 2866
- 152
- Prof. Oskar Aas
De Potensiometri Det er en elektrokjemisk analyseteknikk som er basert på måling av spenning, av et medium eller rom, som aktiviteten eller konsentrasjonen av en art (ionisk eller molekylær) av interesse er bestemt. Det er en ikke -destruktiv teknikk, fordi den ikke søker å endre den kjemiske naturen til den aktuelle analytten.
For å utføre denne analysen er minst to elektroder uunnværlig: en av referanser og en annen indikator eller arbeid. På samme måte må det være en høy impedansvoltmeter, som spenningene måles uten å tillate en betydelig elektronstrøm mellom de to elektrodene og løsningene som omgir dem.
 Generell representasjon av de nødvendige elementene for en potensiometrisk analyse. Kilde: Gabriel Bolívar.
Generell representasjon av de nødvendige elementene for en potensiometrisk analyse. Kilde: Gabriel Bolívar. Over har vi en generell representasjon av forsamlingen for en potensiometrisk analyse. I avdelingen der indikatorelektroden introduseres er arten hvis konsentrasjon vi ønsker å bestemme; Mens vi er i referanseelektroden har vi en annen løsning, der vi kjenner konsentrasjonene av dens komponenter.
Den registrerte spenningsavlesningen skyldes i prinsippet arten av interesse som nærmer seg indikatorelektroden. Med denne spenningen beregner vi konsentrasjonen av denne arten, for eksempel den for CA -ioner2+, AG+, H+, Na+, K+, Cl-, etc. Potentiometri har derfor i klinisk, miljømessig, analytisk og fysisk -kjemisk kjemi.
[TOC]
Grunnleggende
Spenningen som bestemmes i potensiometriske analyser er den av cellen, ogcelle, som er forskjellen mellom spenningene forårsaket av de to elektrodene, indikatoren og referansen. Elektrodene er følsomme for aktivitetene til molekylene eller ionene som omgir dem, kan akseptere elektroner av dem, eller tvert imot gi dem.
De to rommene er tilkoblet, slik at elektrodeelektrode strømmer der reduksjonen oppstår (katode), til elektroden der oksidasjon (anode) finner sted (anode).
Imidlertid er denne overføringen av elektroner (eller strøm) nesten null, siden ellers redoksreaksjonene vil utvikle seg for å endre konsentrasjonene og identitetene til arten som er involvert fullstendig.
Kan tjene deg: hydrogenbromid (HBR)I stedet tillater voltmeteren knapt passering av elektroner, slik at det er en stabil spenningsavlesning, og at cellen kan nå den termodynamiske balansen.
Det sies derfor at potensiometri er en ikke -destruktiv teknikk, fordi få ioner eller molekyler blir transformert til måleprosessen, noe som også er reversibel.
Hovedligninger
Cellepotensial
Potensialet til cellen er relatert til aktivitetene eller konsentrasjonene av arten av interesse gjennom Nernst -ligningen:
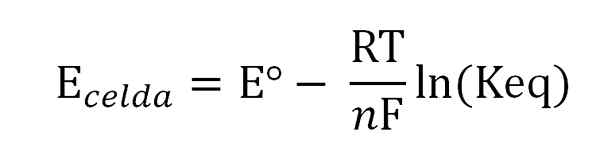 Nernst ligning. Kilde: Gabriel Bolívar.
Nernst ligning. Kilde: Gabriel Bolívar. Hvor eº er potensialet til samme celle under standardbetingelser, f Faraday Constant, n Antallet overført elektroner, r gasskonstanten, og keq balanse konstanten av den globale reaksjonen. Beregningene gjøres ved å rydde keq fra lesingen av ecelle, og beregne ønsket konsentrasjon av balanseuttrykket ditt.
Det er imidlertid praktisk å beregne konsentrasjonene med en enklere rute. Ved konvensjon er cellens potensial også gitt av følgende ligning:
OGcelle = ENett- OGokse
Hvor eNett Det er potensialet for reduksjon semi -media, der indikatorelektroden er lokalisert; mens eokse Det er potensialet for oksidasjon semi -media, der vi har referanseelektroden. Dermed kan ligningen skrives om som:
OGcelle = Eindikator - OGhenvisning + OGJ
Å være eJ lik potensialet forårsaket av skjøteleddene. I praksis, ogJ Det kan ikke bestemmes, men sørg for at verdien er så minimal som mulig ved å bruke veldig utvannede løsninger, eller sikre at komposisjonene i begge rom er like.
Potensialet til analytten
Fra forrige ligning kan vi beregne ogindikator, som er potensialet som virkelig interesserer oss. Med den verdien bruker vi Nernst -ligningen igjen:
Kan tjene deg: Acetonitril (C2H3N)OGindikator = Eº - (RT/NF) ln (rød/okse)
Nettverk er den reduserte formen for analytten eller arten av interesse, og okse er dens oksiderte form. Forutsatt at analytten er kationene Zn2+ På en metallisk sinkelektrode ville vi ha:
OGindikator = EºZn2+/Zn - (RT/NF) LN (1/tilZn2+)
Hvor tilZn2+ Det er Zn kationaktivitet2+, som ved eksperimentelle justeringer er ganske nær konsentrasjonen, [Zn2+]. Fra denne ligningen blir Zn -konsentrasjonen fjernet2+, Det som kan sees, påvirker direkte verdien av eindikator.
Den reduserte formen for sink, Zn, presenterer en aktivitet lik 1. Derfor vil den generelle ligningen for rustne kationer av et metall som fungerer som en elektrode være lik:
OGindikator = EºMn+/m - (RT/NF) LN (1/tilM+n)
Men dette gjelder bare for første artselektroder.
Elektroder
Elektroder, i tillegg til Voltmeter, er de viktigste elementene i enhver potensiometrisk analyse. Noen av dem vil bli nevnt nedenfor.
Første art
De første artselektrodene er metaller som oksiderer for å forårsake kationer, og utfører elektroner til voltmeteret. Noen av disse er følgende: AG, Zn, Cu, HG, SN, TL, CD og BI.
Ikke alle metaller fungerer som førsteklasseelektroder, fordi de ikke skal presentere krystallinske uregelmessigheter eller overflater dekket av oksydlag som forårsaker ustabile spenninger.
Andre art
Andre artselektroder er derimot også metall, men inneholder også et salt på overflaten, hvis løselighet avhenger av redoksreaksjonene som finner sted. For eksempel Ag-Agcl og Hg-HG elektroder2Cl2 (Calomel), er andre artselektroder.
Selektive ioner
De selektive ionelektrodene, også kjent som membraner, er de som er følsomme for et spesifikt ion eller molekyl, som sniker seg gjennom en membran designet bare for at han skal passere og ikke de andre artene i løsning.
Kan tjene deg: begrensende og overdreven reagensFavoritteksemplet på denne typen elektrode er glasset, bygget for å bestemme konsentrasjonen av H -ioner3ENTEN+ eller h+, Og tjener dermed som et pehometer.
Potentiometri -applikasjoner
Enviromental kjemi
Potentiometri har blitt brukt i miljøkjemi i bestemmelsen av CN -ioner-, F- og ikke3-, så vel som ammoniakk i vannstrømmer.
Klinisk kjemi
Selektive elektroder er veldig nyttige når målemediet er komplisert. Derfor vil de andre ionene eller molekylene forstyrre avlesningene.
Denne egenskapen er spesielt gunstig i de potensiometriske bestemmelsene utført i de samme cellene, der mikroelektroder blir injisert for å bestemme K K -konsentrasjonene+, Na+, Cl-, Ac2+ eller h+.
Potensiometriske grader
Anta at i midten der vi har indikatorelektroden er en tittel lagt til som reagerer med analytten, og derfor endrer den konsentrasjonen. Da vil endringer skje i Ecelle, som vil samsvare på samme måte som endring av pH i en syre-base-titrering.
Dermed grafering ogcelle vs. VTitulant, Vi kan bestemme vendepunktet eller ekvivalensen, og med det vil vi kjenne konsentrasjonen av analytten.
Potensiometriske grader er mye brukt i analytiske og fysisk -kjemiske kjemilaboratorier. Noen av analyttene som kan bestemmes med denne teknikken er følgende: Tro2+, HCO3-, Ac2+, Mg2+, Cu2+, askorbinsyre, haluros, blant andre.
Alle grader, til en viss grad, kan følges via potensiometrisk i stedet for å ty til indikatorene og deres endelige punkter.
Referanser
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kjemi (Femte utg.). Pearson Prentice Hall.
- Skoog d.TIL., Vest d.M. (1986). Instrumental analyse. (Second Ed.). Inter -amerikansk., Mexico.
- Dr. Doug Stewart. (2020). Definisjon av potensiometri. Gjenopprettet fra: Chemicool.com
- Harvey David. (5. juni 2019). Potntiometriske metoder. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Britannica Encyclopaedia. (2020). Elektrogravimetri. Gjenopprettet fra: Britannica.com
- Wikipedia. (2020). Elektroanalytiske metoder. Hentet fra: i.Wikipedia.org

