Referanseelektrodeegenskaper, funksjon, eksempler
- 4960
- 860
- Prof. Theodor Gran
Han referanseelektrode Det er en enhet som brukes i potensiometrisk og voltamétrisk analyse for den kvantitative bestemmelsen av en analyt. Dets betydning er, som navnet tilsier, å tjene som en referanse for å estimere den sanne verdien av potensialet i reaksjonen fra en elektrokjemisk semi -LK.
Potensialene til en semi -media avhenger av konsentrasjonen av et ion i interesse, siden det reagerer ved å vinne eller miste elektroner. På denne måten er det mulig å bestemme konsentrasjonen deres gjennom disse potensialene. Verdiene deres er imidlertid ikke absolutte, men relatert til standard hydrogenelektrode (hun på engelsk).
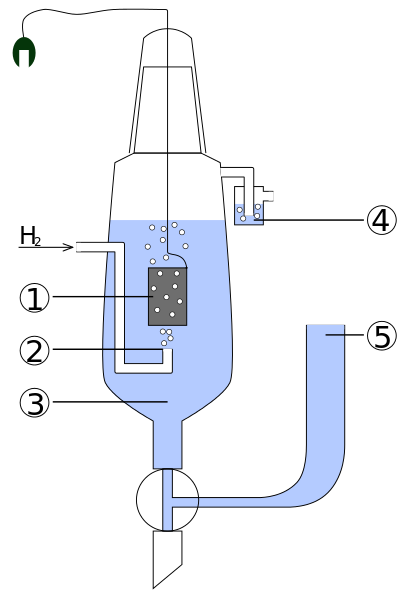
 Diagram over delene av en standard hydrogenelektro. Kilde: Standard_hydrogen_electrode.JPG: Kaverinderivevativt arbeid: Henry Muelpfordt/CC BY-S (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)
Diagram over delene av en standard hydrogenelektro. Kilde: Standard_hydrogen_electrode.JPG: Kaverinderivevativt arbeid: Henry Muelpfordt/CC BY-S (http: // CreativeCommons.Org/lisenser/by-SA/3.0/) Ved konvensjon er hydrogenelektroderpotensialer lik 0V. Problemet er at disse elektrodene er vanskelige å manipulere, så de er ikke praktiske å installere dem i alle analyser. Det er her referanseelektroder kommer inn, mye enklere og hvis potensial er forskjellig fra 0v.
Noen av referanseelektrodene, for eksempel Calomels mettede elektrode (ESC), kan bygges i samme laboratorium før analysen utføres. På samme måte oppnås de åpent i markedet med sine riktige spesifikasjoner, og risikoen for å forurense utvalget av analytten er minimal.
[TOC]
Referanseelektrodeegenskaper
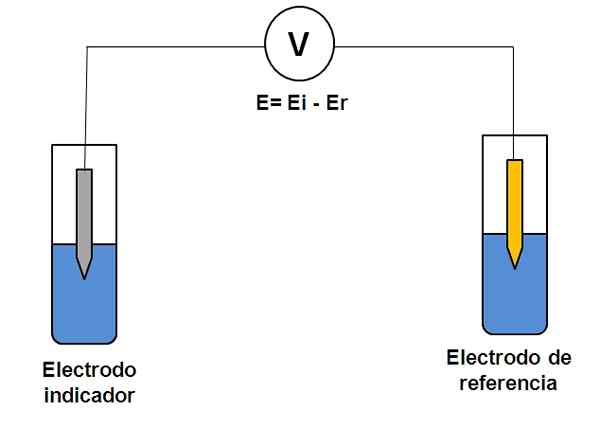 Enkel representasjon av et to elektrodesystem i potensiometri. Kilde: Gabriel Bolívar.
Enkel representasjon av et to elektrodesystem i potensiometri. Kilde: Gabriel Bolívar. Tenk på de to elektrodesystemene ovenfor. Den ene er indikatoren (grå), der reaksjonen av interesse finner sted, og den andre er referansen (gull). Denne elektrokjemiske cellen vil ha et potensial og, som vil være lik forskjellen på potensialene til begge elektroder (EI-E). Derfor må enhver variasjon i E skyldes potensialet til indikatorelektroden.
Kan tjene deg: kaliumcyanid (KCN): egenskaper, bruksområder, strukturer, risiko,Fra ovenstående konkluderes det med at referanseelektroden har følgende egenskaper:
-Det har et stabilt potensial i løpet av tiden og er reproduserbar. Det vil si at det skal være det samme uavhengig av hvor eller hvor mange ganger målingene blir gjort.
-Den kjemiske sammensetningen er konstant og ufølsom, så den gjennomgår neppe endringer når den samhandler med løsningen av analytten eller fordyper seg i et vandig medium.
-Det er enkelt å bygge og montere, i motsetning til standard hydrogenelektrode, som krever bruk av en hydrogentank og risikerer eksplosjonsrisiko når hydrogen blandes med luften med luften.
Indikatorelektroden er en som er følsom for konsentrasjonen av analytten.
Referanseelektrodefunksjon
Referanseelektroderpotensialer måles mot standard hydrogenelektrode, så verdiene deres er forskjellige fra 0V. Takket være disse hydrogenelektrodene er konstruksjonen av standard- og °.
I praksis laster det imidlertid ikke en hydrogenelektrode overalt. I stedet brukes referanseelektroder, mye enklere og trygt for å manipulere.
Ettersom potensialene er konstante og stabile, skyldes de potensielle avlesningene av elektrokjemicellen utelukkende indikatorelektroden; det vil si til variasjonene av konsentrasjonen av den aktuelle analytten.
Dermed er referanseelektrodefunksjonen å bestemme potensialet for enhver reaksjon i en av semi -bokstavene til det elektrokjemiske systemet. Hvis potensialene deres ikke var stabile, ville ikke de kvantitative bestemmelsene av analytten være pålitelige. Enhver potensiometrisk eller voltametrisk analyse skal spesifisere hvilken referanseelektrode de brukte for å rapportere resultatene sine.
Det kan tjene deg: Bromousyre (HBRO2): Fysiske og kjemiske egenskaper, og brukerReferanseelektroder eksempler
Det er flere tilgjengelige referanseelektroder på markedet. Noen brukte til veldig spesifikke bestemmelser. Imidlertid er det to elektroder blant dem alle som skiller seg ut takket være deres enkelhet og praktiske: Calomel-elektroden, og sølv-sølv-cllorid, begge veldig tilbakevendende i mange potensiometriske og voltamletriske analyser.
Calomel elektrode
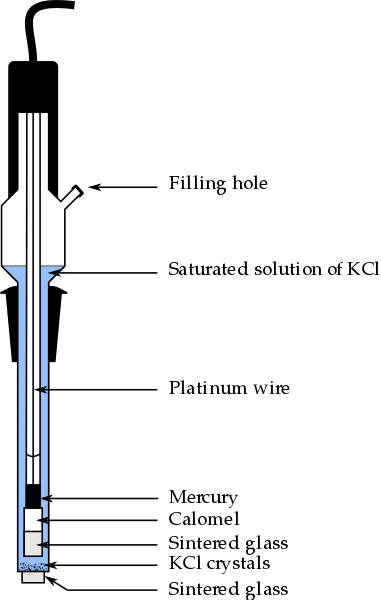 Deler av Calomel -elektroden, en av de mest brukte referanseelektrodene i analytisk kjemi. Kilde: Bachi-Bouzouk via Wikipedia.
Deler av Calomel -elektroden, en av de mest brukte referanseelektrodene i analytisk kjemi. Kilde: Bachi-Bouzouk via Wikipedia. I det øvre bildet vises de konvensjonelle delene av en mettet kalomelelektrode, ECS. Det sies at den er mettet fordi den inneholder en mettet løsning av KCl (blå), som også presenterer avvikling av KCL.
Den indre kolonnen, reist av en platinatråd, er fylt med kvikksølv, som igjen kontakter en kalomelpasta, HG2Cl2 o Merkurklorid (I), og den mettede løsningen av KCL. I denne elektroden er konsentrasjonen av CL -ionene viktig-, Siden verdien endrer elektrodens potensiale.
Reaksjonen som finner sted er som følger:
Hg2Cl2(S) + 2e- ⇌ 2Hg (L) + 2Cl-
Og den har en eº på 0.241 v.
I den nedre enden av ECS er det en porøs stekt, som settes i elektrisk kontakt med løsningen av analytten og tillater kontrollert utveksling av ioner-. Ellers ville det være forurensning av klorider i prøven, og også elektroden ville miste sin dyrebare mettede KCL -løsning.
Denne elektroden brukes til pH -målinger og generelt av enhver analyt hvis konsentrasjon kan bestemmes i et vandig medium.
Det kan tjene deg: termisk alkohol: struktur, egenskaper, risikoer og brukSølv sølvelektrode
 Silver Silver Electro. Kilde: TenoFallTrades (snakk) (opplastinger). / Offentlig domene
Silver Silver Electro. Kilde: TenoFallTrades (snakk) (opplastinger). / Offentlig domene I likhet med Calomels elektrode, består sølvsølvelektroden av en sølvtråd dekket med sølvklorid, og også nedsenket i en løsning mettet av en blanding av KCl og AgCl.
Alle delene er beskyttet i et plastrør, som har en porøs åpning som den etablerer elektrisk kontakt med løsningen.
Reaksjonen som definerer potensialet, eº = 0.197 V, er som følger:
Agcl (S) + e- ⇌ Ag (er)+CL-
Denne elektroden presenterer større bruksområder og preferanser enn Calomel, noe som skyldes den negative effekten av kvikksølv på miljøet. På den annen side er sølvfolide sølvelektroder enklere, trygge og billige å bygge i laboratoriet.
Vi sier da at sølvgaffelektroden erstatter Calomel i mange av bruksområdene (potensiometriske grader, korrosjonstester, elektrokjemisk analyse, etc.).
Det er også et av de foretrukne alternativene innen biologi og medisin, spesielt for elektrokardiografi og elektroencefalografi, siden sølv eller deres salt er relativt giftige stoffer for kroppen.
Referanser
- Dag, r., & Underwood, a. (1965). Kvantitativ analytisk kjemi. (Femte utg.). Pearson Prentice Hall.
- Skoog d.TIL., Vest d.M. (1986). Instrumental analyse. (Second Ed.). Inter -amerikansk., Mexico.
- Wikipedia. (2020). Elektrodereferanse. Hentet fra: i.Wikipedia.org
- Elsevier f.V. (2020). Elektrodereferanse. Scientedirect. Hentet fra: Scientedirect.com
- Kjemi librettexts. (9. juni 2020). Referanseelektroder. Gjenopprettet fra: Chem.Librettexts.org
- « Alexandria fyrtårn, historie, beskrivelse, ruiner
- Emily Dickinson biografi, prestasjoner, verk, setninger »

