Svake elektrolytter konsept, egenskaper, eksempler
- 3948
- 1148
- Jonathan Carlsen
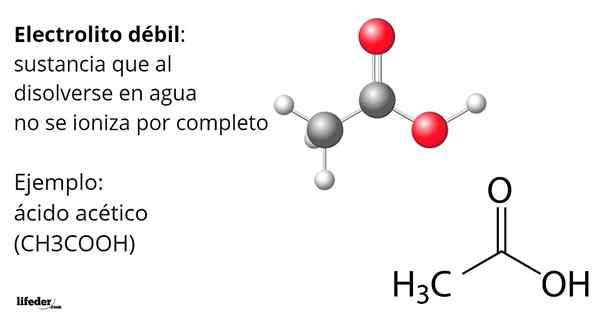
EN Svak elektrolytt Det er alt det stoffet som løses opp i vann, er ikke fullstendig ionisert. Dette betyr at oppløsningen produserer eller frigjør lavere mengder ioner enn det som kan forventes. Denne ioniseringsprosessen er etablert ved en hydrolysebalanse, der det dannes ioner som h dannes3ENTEN+ eller åh-.
Svake elektrolytter er vanligvis kovalente forbindelser, hvis molekyler har en tendens til å forbli nøytrale uten å skaffe ioniske belastninger. Mange av disse elektrolyttene består av organiske molekyler med ioniserbare funksjonelle grupper, selv om det også er uorganiske typer, inkludert flere oksacider.

Eddiksyre, cho3COOH, er et eksempel på en svak elektrolytt. Molekylet har en funksjonell gruppe som kjennetegner surheten i vann. Imidlertid, når ikke alle molekyler er oppløst, produserer H -ioner3ENTEN+ Transformasjon i acetatanion, Cho3COO-, Men de forblir nøytrale, protonert.
Noen elektrolytter er svakere enn andre, noe som vil avhenge av graden av deres ioniseringer. Når de oppløses, forårsaker de moderate endringer i pH. Dermed har vi sure eller grunnleggende svake elektrolytter.
[TOC]
Kjennetegn på svake elektolitter
De er kovalente forbindelser
Generelt sett er svake elektrolytter kovalente forbindelser, så deres bestanddeler er molekyler.
De lider av hydrolyse
Disse molekylene har muligheten til å skaffe ioniske belastninger. For å gjøre dette, delta i en hydrolysebalanse, der et vannmolekyl er "del" i OH-, eller godta et hydrogen for å transformere seg til h3ENTEN+.
Jo mindre sannsynlig eller ustabil er hydrolyse, jo lavere er mengden eller konsentrasjonen av ioner som er til stede i oppløsningen av disse elektrolyttene.
De har lav konduktivitet
Løsningene av svake elektrolytter er ikke så gode elektrisitetsledere, sammenlignet med sterke elektrolytter. Dette skyldes nettopp det laveste antallet ioner i løsning, noe som gjør det vanskelig å passere elektronene gjennom vann.
Det kan tjene deg: mangan eller permangansyreEksempler på svake elektrolytter
 Eddiksyre av epleeddik er det mest representative eksemplet på en svak elektrolytt. Kilde: Pxhere.
Eddiksyre av epleeddik er det mest representative eksemplet på en svak elektrolytt. Kilde: Pxhere. Kullsyre
Kullsyremolekylet, H2Co3, Når du oppløses i vann, lider følgende hydrolysereaksjon:
H2Co3 + H2Eller ⇌ HCO3- + H3ENTEN+
Problemet er at ikke alle h2Co3 Det er ionisert i HCO3-. I tillegg h2Co3 Det uforholdsmessig i seg selv i karbondioksid og vann, noe som reduserer konduktiviteten til denne løsningen ytterligere.
For de gjenværende eksemplene vil dette faktum være gjenvidelig: et molekyl, som i prinsippet er nøytralt, skaffer seg ionisk belastning, og i prosessen mediert av hydrolyse er det ioner h3ENTEN+ eller åh-.
AmonYoAc
Ammoniakkmolekylet, NH3, Når du oppløses i vann, lider følgende hydrolysereaksjon:
NH3 + H2Eller ⇌ NH4+ + Åh-
Disse ammoniale løsningene skyter en skarp lukt.
Denne gangen har vi OH -ioner-. Ammoniakk er en svak base, mens kullsyre, en svak syre. Derfor er syrer og svake baser klassifisert som svake elektrolytter, siden de delvis blir ionisert uten å frigjøre høye konsentrasjoner av hones h3ENTEN+ eller åh-, henholdsvis.
TILFosf syreentenrik
Fosforsyre, h3Po4, Det er et eksempel på en svak oksoacid, som igjen er en elektrolytt:
H3Po4+ H2Eller ⇌ h2Po4- + H3ENTEN+
Fosforsyre er fremdeles i stand til å lide to andre dissosiasjoner, en for hvert syrehydrogen (tre totalt). Konsentrasjonen av h3ENTEN+ produsert er mindre hvis sammenlignet med en sterk oksoacid, for eksempel salpetersyre, HNO3, som er en sterk elektrolytt. Jo svakere elektrolytten, jo mindre sur eller grunnleggende vil være.
HydentenGeno
Hydrogenfluorid, HF, er et eksempel på en uorganisk kovalent forbindelse som, uten å være en oksoacid, er en svak elektrolytt fordi det er en svak syre. Når du oppløses i vann, produseres fluorhoric acid, som delvis er ionisert:
Kan tjene deg: kobolthydroksidHF+ H2Eller ⇌ f- + H3ENTEN+
Til tross for at de ikke er en sterk elektrolytt, er fluorsyre i stand til å "spise" glasset med materialer som ofte brukes til å lagre syreoppløsninger.
Pyridin
Pyridinet, C5H5N, er en amin som er hydrolysert for å danne ioner oh-:
C5H5N + h2Eller ⇌ c5H5NH + + Åh-
Pyridin er mer grunnleggende enn ammoniakk, så ioniseringen vil være større og vil derfor produsere større konsentrasjoner av OH -ioner-.
TILCianh syreYoDrico
Cyanhydrinsyre, HCN, er også et annet eksempel på en svak syre og elektrolytt:
HCN + H2Eller ⇌ CN- + H3ENTEN+
Uoppløselige salter
Dette poenget er kontroversielt. Så langt svake elektrolytter er blitt klassifisert som svake syrer eller baser, preget av deres delvise ioniseringer. Uoppløselige salter i vann, som allerede er ionisert i krystaller, har imidlertid også blitt betraktet som svake elektrolytter.
Når du løses opp med vanskeligheter med vann, er mengden ioner som frigjøres i oppløsningen liten sammenlignet med løselige salter. I denne forstand produserer uoppløselige salter mindre ledende løsninger, noe som formørker dem litt som sterke elektrolytter.
Av denne grunn vil det her antas at disse saltene tilhører den svake elektrolyttergruppen, selv når du oppløser genererer nøytrale ioner og nøytrale molekyler med ioniseringsgrader.
Sølvklorid
Sølvklorid, AgCl, oppløses i vann for å produsere Ag -ioner+ og cl-. Imidlertid er det et ganske uoppløselig salt. Mengden ioner som frigjøres er mye lavere enn det som ville hatt hvis det var helt løselig, som med sølvnitratet, agno3, En sterk elektrolytt.
Kan tjene deg: spredt faseKalsiumkarbonat
Kalsiumkarbonat, Caco3, Det er et uoppløselig salt som ved å løse opp delvis produserer CA -ioner2+ og co32-. Dette saltet, i motsetning til AGCL, er grunnleggende, fordi CO32- er hydrolysert for å generere ioner oh-.
Sinksulfat
Sinksulfat, zonso4, Det er delvis oppløst i vannet for å produsere Zn -ioner2+ Og så42-.
Kalsiumfluorid
Kalsiumfluor, CAF2, Naturlig funnet som fluorittmineral, oppløses det bare i vannet for å produsere CA -ioner2+ og f-.
Magnesiumoksid
Magnesiumoksid, MgO, er en ganske uoppløselig ionisk forbindelse i vann. Den lille delen som oppløses reagerer på transformasjon til det tilsvarende hydroksid, Mg (OH)2, som er den virkelige ansvarlige for utseendet til MG -ionene2+ Og åh-.
Derfor kan MGO, til tross for at han er ionisk, ikke klassifiseres som en sterk elektrolytt, fordi den i vannet ikke frigjør ioner av sine egne krystaller (MG2+ Jeg2-).
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Chung & Chieh. (5. juni 2019). Elektrolytter. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Helmestine, Todd. (11. februar 2020). Svak elektrolyttdefinisjon og eksempel. Gjenopprettet fra: Thoughtco.com
- Danielle Reid. (2020). Svak elektrolytt: Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com

