Elektronegativitet
- 4738
- 365
- Markus Fredriksen
Hva er elektronegativitet?
De Elektronegativitet Det er en relativ periodisk egenskap som angår evnen til et atom med å tiltrekke elektronisk tetthet av det molekylære miljøet. Dette er trenden til et atom for å tiltrekke elektroner til seg selv når det er festet til et molekyl. Dette gjenspeiles i oppførselen til mange forbindelser og hvordan intermolekylært samhandler med hverandre.
Med andre ord, jo mer elektronegativ er det et atom, jo større er evnen til å tiltrekke elektroner av andre atomer; Det vil også ha et høyere ioniseringspotensial, som lar deg opprettholde elektronene dine i møte med ekstern attraksjon mens du tiltrekker elektroner i de omkringliggende atomer.
Nå tiltrekker ikke alle elementer elektroner med tilstøtende atomer i samme grad. Når det gjelder de som gir elektronisk tetthet, sies det at de er elektropositiv, Mens de som "dekker" elektroner er elektronegativer. Det er mange måter å forklare og observere denne egenskapen (eller konseptet).
For eksempel på kartene over elektrostatiske potensialer for et molekyl (for eksempel klordioksidet til det overlegne bildet, CLO2) Effekten av de forskjellige elektronegativitetene for klor- og oksygenatomer observeres.
Den røde fargen indikerer regionene rike på elektroner i molekylet, Δ- og den blå fargen som er dårlige av elektroner, Δ+. Etter en serie beregningsberegninger kan denne typen kart etableres; Mange av dem viser et direkte forhold mellom plasseringen av elektronegative atomer og Δ-.
Det kan også visualiseres som følger: Innenfor et molekyl er det mer sannsynlig at transitt av elektroner forekommer i nærheten av de mest elektronegative atomer.
Det er av denne grunn at CLO for CLO2 Oksygenatomer (røde kuler) er omgitt av en rød sky, mens kloratom (den grønne sfæren) til en blåaktig sky.
Definisjonen av elektronegativitet avhenger av tilnærmingen som er gitt til fenomenet, det er flere skalaer som vurderer det fra forskjellige aspekter. Imidlertid har alle skalaer til felles at de støttes av atomerens iboende natur.
Elektronegativitetsskalaer
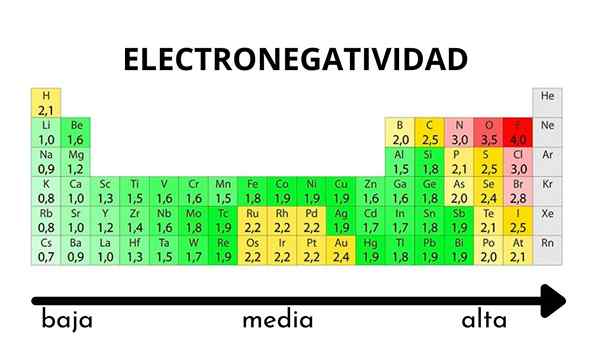
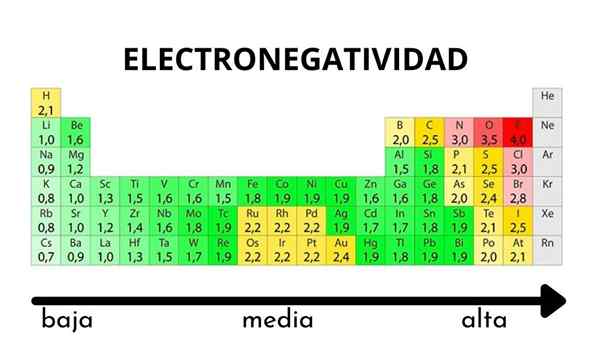 I den periodiske tabellen kan det observeres når verdien av elektronegativitet øker eller reduseres
I den periodiske tabellen kan det observeres når verdien av elektronegativitet øker eller reduseres Elektronegativitet er ikke en egenskap som kan kvantifiseres og heller ikke har absolutte verdier. Dette er fordi trenden med et atom med å tiltrekke elektronisk tetthet mot ham ikke er den samme i alle forbindelser. Med andre ord: elektronegativitet varierer avhengig av molekylet.
Hvis for CLO -molekylet2 Atomen til CL vil bli endret til N, da vil tendensen til OR til å tiltrekke elektronene også bli endret; Det kan økes (få Redst -skyen) eller reduseres (miste farge). Forskjellen ville ligge i den nye dannede N-O-koblingen, for å ha O-N-O-molekylet (nitrogendioksid, nei2).
Det kan tjene deg: Forhold mellom kjemi og teknologi med menneske, helse og miljøSiden elektronegativiteten til et atom ikke er den samme for alle dets molekylære miljøer, er det nødvendig å definere det i henhold til andre variabler. På denne måten er det verdier som fungerer som en referanse, og som tillater å forutsi for eksempel typen lenke som dannes (ionisk eller kovalent).
Pauling skala
Den store forskeren og vinneren av Two Nobel Awards, Linus Pauling (1901-1994), oppvokst i 1932 en kvantitativ (målbar) form for elektronegativitet, kjent som Pauling Scale. I den var elektronegativiteten til to elementer, A og B, som danner lenker, relatert til den ekstra energien forbundet med den ioniske karakteren til A-B-lenken.
Teoretisk sett er de kovalente bindingene de mest stabile, siden fordelingen av elektronene mellom to atomer er rettferdig; Det vil si at for A-A- og B-B-molekylene deler begge atomene bindingene på samme måte. Imidlertid, hvis A er mer elektronegativ, vil nevnte par være mer enn av B.
I så fall er A-B ikke lenger fullstendig kovalent, selv om det ikke er veldig viktig. Når dette skjer, gjennomgår lenken liten ustabilitet og tilegner seg ekstra energi som et produkt av elektronegativitetsforskjellen mellom A og B.
Jo større denne forskjellen er, jo mer er energien til A-B-lenken, og følgelig, jo større er den ioniske karakteren til nevnte lenke.
Denne skalaen representerer den mest brukte i kjemi, og verdiene til elektronegativiteter dukket opp fra tildelingen av en verdi på 4 for fluoratomet (elementet med den laveste elektronegativiteten er cessium, med 0,7). Derfra kunne de beregne det av de andre elementene.
Mulliken skala
Mens Pauling-skalaen har å gjøre med energien som er knyttet til koblingene, er Robert Mulliken Scale (1896-1986) mer relatert til to andre periodiske egenskaper: ioniseringsenergi (EI) og elektronisk affinitet (AE).
Dermed er et element med høye verdier av EI og AE veldig elektronegativt, og derfor vil det tiltrekke elektroner fra det molekylære miljøet.
Fordi? Fordi det gjenspeiler hvor vanskelig det er å "starte" et eksternt elektron, og hvor stabil anionen som dannes i en gassfase er så stabil. Hvis begge egenskapene har høye størrelser, er elementet "kjæreste" av elektroner.
Kan tjene deg: fusjonMulliken elektronegativiteter beregnes med følgende formel:
ΧM = ½ (EI + AE)
Det vil si χM Det er lik gjennomsnittsverdien til EI og AE.
I motsetning til Pauling -skalaen som avhenger av hvilke atomer som danner koblinger, er dette imidlertid relatert til egenskapene til staten Valencia (med sine mest stabile elektroniske konfigurasjoner).
Begge skalaene genererer lignende elektronegativitetsverdier for elementene og relaterer omtrent til følgende konvertering:
ΧP = 1.35 (χM)1/2 - 1.37
Begge xM som xP De er dimensjonsløse verdier; det vil si at de mangler enheter.
Skala av a.L. Allred og e. Rochow
Det er andre skalaer av elektronegativitet, for eksempel Sanderson og Allen. Imidlertid er den som følger de to første Allred og Rochow Scale (χAr). Denne skalaen er basert på den effektive kjernefysiske belastningen som et elektron opplever på overflaten av atomene. Derfor er det direkte relatert til den attraktive kraften i kjernen og skjermeffekten.
Hvordan varierer elektronegativitet i den periodiske tabellen?
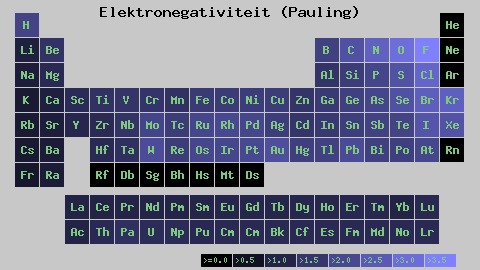 Pauling elektronegativitetsskala. Kilde: Wikimedia Commons
Pauling elektronegativitetsskala. Kilde: Wikimedia Commons Uansett skalaer eller verdier som den har, øker elektronegativiteten fra høyre til venstre i en periode, og fra bunnen av i gruppene. Dermed øker den mot øverste høyre diagonal (ikke teller helium) før fluoren er.
I det overordnede bildet, det nyutviklede. I det periodiske tabellen kommer Pauling Electronegativities uttrykt i henhold til fargene på boksene. Ettersom fluor er det mest elektronegative, er det opp til det en mer grov lilla farge, mens de mindre elektronegative (eller elektropositive) fargene mørkere.
Det kan også sees at gruppehoder (H, BE, B, C, etc.) De har de klareste fargene, og ettersom gruppen er avstammet av de andre elementene. Hva handler dette om? Svaret er igjen i EI, AE, ZEF (Effektiv kjernefysisk belastning) og på atomradius.
Atomet i molekylet
Individuelle atomer har en reell kjernefysisk Z og ytre elektroner lider et effektivt kjernefysisk belastningsprodukt av skjermingseffekten.
Når den beveger seg over en periode, øker Zef på en slik måte at atomet blir kontrahert; det vil si at atomradioer reduseres gjennom en periode.
Dette resulterer i at på tidspunktet for å koble et atom med et annet, vil elektronene "flyte" til atomet med større zef. Dette gir også en ionisk karakter til lenken hvis det er en markant trend med elektroner å gå til et atom. Når ikke, er det snakk om et overveiende kovalent bånd.
Kan servere deg: fiolett glassAv denne grunn varierer elektronegativitet i henhold til atomradioer, Zef, som igjen er nært beslektet med EI og AE. Alt er en kjede.
Elektronegativitet nytteverdi
Elektronegativitet tjener i prinsippet for å avgjøre om en binær forbindelse er kovalent eller ionisk. Når elektronegativitetsforskjellen er veldig høy (med en hastighet på 1.7 enheter eller mer) Det sies at forbindelsen er ionisk.
Det er også nyttig å skille i en struktur som regioner muligens vil være rikere på elektroner.
Herfra kan det forutses hvilken mekanisme eller reaksjon som kan lide forbindelsen. I fattige regioner av elektroner, Δ+, er det mulig at negativt ladede arter oppnådd på en viss måte; Og i regionene som er rike på elektroner, kan atomene deres samhandle på veldig spesifikke måter med andre molekyler (dipol-dipolo-interaksjoner).
Eksempler (klor, oksygen, natrium, fluor)
Hva er elektronegativitetsverdiene for klor, oksygen, natrium og fluoratomer? Etter fluor, som er det mest elektronegative? Ved hjelp av den periodiske tabellen observeres det at natrium har en mørk lilla farge, mens oksygenfarger og klor er visuelt veldig like.
Deres elektronegativitetsverdier for skalaene til Pauling, Mulliken og Allred-Row er:
Na (0.93, 1.21, 1.01).
Eller (3.44, 3.22, 3.femti).
CL (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Merk at med numeriske verdier er det en forskjell mellom negativitetene til oksygen og klor.
I følge Mulliken-skalaen er klor mer elektronegativ enn oksygen, i motsetning til Pauling og Allred-Rhochow Scales. Forskjellen i elektronegativitet mellom begge elementene er enda tydeligere ved bruk av allred-rHow-skalaen. Og til slutt er fluor, uavhengig av valgt skala, det mest elektronegative.
Derfor, der det er et atom av F i et molekyl, betyr derfor at lenken vil ha en høy ionisk karakter.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., p. 30 og 44). Mc Graw Hill.
- Jim Clark. (2000). Elektronegivitet. Hentet fra: Chemguide.co.Storbritannia
- Anne Marie Helmestine, pH.D. (11. desember 2017). Elektronegatitetsdefinisjon og eksempel. Tatt fra: Thoughtco.com
- Mark e. Tuckerman. (5. november 2011). Elektronegatitetsskala. Hentet fra: nyu.Edu
- Wikipedia (2018). Elektronegativitet. Hentet fra: det er.Wikipedia.org

