Kovalent binding
- 4693
- 1129
- Daniel Skuterud
Hva er en kovalent lenke?
Den kovalente bindingen er et sterkt samspill som lar to eller flere atomer slå seg sammen for å danne molekyler. Dette er en av typene kjemiske bindinger der et par elektroner deltar som kommer fra de ytterste orbitalene til atomene som er koblet sammen.
I teorien bidrar hvert atom med en av de to elektronene når de kobler kovalent, slik at de vinner stabilitet. Paret med elektroner, som blir en slags "elektronisk krok" mellom de to atomkjernene, deles likt mellom to identiske atomer, men dette skjer ikke når de to atomene er av to forskjellige elementer.
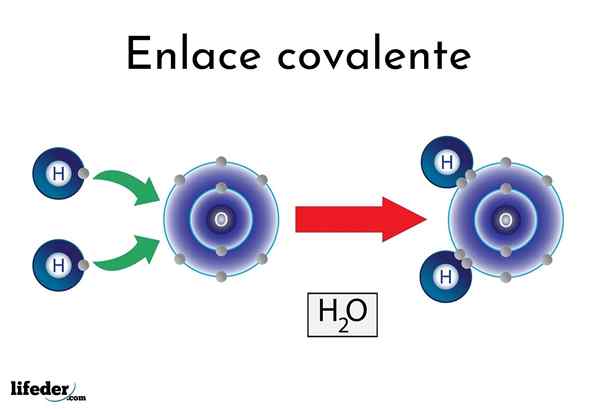
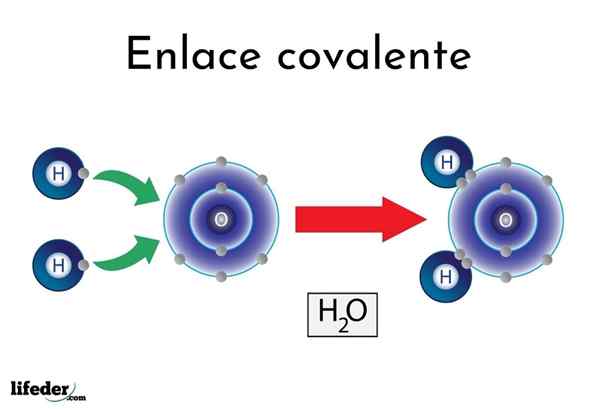 Vann kovalent binding
Vann kovalent binding Det er atomer eller elementer som har en naturlig tendens til å gi elektroner, mens andre foretrekker å vinne dem.
For eksempel det berømte vannmolekylet, h2Eller, den har to kovalente lenker: h-o-h. Hydrogener og oksygen deler de to parene med elektroner, men disse bane nærmere oksygenatomet enn hydrogen. Dette fenomenet skyldes polaritet og elektronegativitet.
Kjennetegn på kovalente bindinger
De kovalente bindinger presenterer følgende egenskaper:
-De involverer et par elektroner for hver kovalente binding.
-Lengdene uttrykkes vanligvis i PM (Picometers) eller Armstrong (Å) enheter.
-De er vanskelige å bryte, noe som betyr at de er veldig sterke.
-Når de går i stykker, oppstår kjemiske forandringer eller transformasjoner, siden molekylet mister atomer. I denne prosessen blir energi absorbert.
-Når de dannes, blir et nytt molekyl født. I denne prosessen frigjøres energi.
Kan tjene deg: Kjemiske reaksjoner: Kjennetegn, deler, typer, eksempler-Lengdene varierer i henhold til aviditeten som et av de koblede atomene har mot paret av elektroner; Det vil si at jo mer det tiltrekker det, den kovalente lenken blir forlenget.
-De enkleste kovalente bindinger eksisterer bare mellom to atomer samtidig, og er representert med et skript eller linje (-).
Det er andre funksjoner som gjelder for mer komplekse kovalente lenker, som imidlertid også samsvarer med det som er kommentert ovenfor.
Typer kovalente lenker
De kovalente bindingene kan i prinsippet klassifiseres på to måter: i henhold til antall elektroner som deles, og i henhold til den resulterende polariteten når molekylet er dannet. Begge vil bli beskrevet overfladisk nedenfor.
I henhold til antall delte elektroner
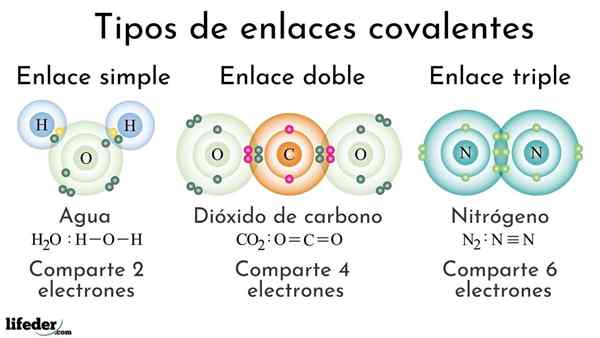 Typer kovalente bindinger i henhold til antall delte elektroner
Typer kovalente bindinger i henhold til antall delte elektroner Kovalente bindinger i henhold til antall delte elektroner kan klassifiseres som enkle, doble eller trippel. I det øvre bildet vises disse respektive koblinger for tre molekyler som vil bli diskutert nedenfor, vises.
-
Enkel
Den enkle kovalente bindingen er en der det bare er et par elektroner, det vil si to elektroner. Et eksempel på denne lenken vi ser i vannmolekylet, h2ENTEN. Legg merke til at av alle kovalente obligasjoner, er den enkle, i-i, den lengste av alle. Dette er nesten alltid.
-
Dobbelt
I den doble kovalente bindingen har vi, som navnet tilsier, to par elektroner, noe som betyr at det er fire elektroner som forsterker den "elektroniske kroken" mellom de to koblede atomer.
Det vil si at en dobbeltbinding (=) er sterkere enn en enkel (-). Imidlertid er det mer reaktivt, som selv om det kan virke selvmotsigende, er lett å forklare med tanke på overlappingen av atomiske orbitaler.
Kan tjene deg: Polaritet (kjemi): Hva er definisjon, eksemplerEt eksempel på denne lenken sees i karbondioksidmolekylet, CO2. De to oksygenatomene forblir sterkt forent til karbon takket være denne bindingen, eller = c = o, som for å være sterkere, nærmere atomer; Og i sin tur fører dette til at lenken blir forkortet.
-
Trippel
Trippelkoblingen er den sterkeste og korteste av kovalente bindinger (vanlig). Merk at for nitrogenmolekylet, n2 eller N≡N, atomene deres representert av blålige kuler er veldig nær hverandre.
I trippelkoblingen har vi tre elektronpar, som er lik seks elektroner som forsterker den kovalente bindingen mellom de to atomene.
-
Dativ
Dativkoblingen er en spesiell type enkel kobling som består i paret med elektroner kommer bare fra et av de to koblede atomer. Det vil si at det kan sees på som en "tvangsdeling".
For eksempel M -molekylet2Eller bruk et av oksygenfrie par for å donere dem til et ion h+ (H2O: → h+ = [H2ÅH]+ eller h3ENTEN+).
I følge polaritet
Kovalente bindinger i henhold til polaritet kan klassifiseres som polar kovalent eller ikke -polar kovalent.
-
Polar kovalente bindinger
Det forekommer mellom to forskjellige atomer hvis forskjell med elektronegativitet er stor. Dette resulterer i dannelse av en dipol, der et atom konsentrerer seg negativt (tiltrekker elektroner), mens den andre konsentrerer seg positivt (gir elektroner). For eksempel er HF (H-F) kovalent binding polar, fordi fluor er mer elektronegativ enn hydrogen.
-
Ikke -polare kovalente lenker
Det forekommer mellom to identiske atomer hvis forskjell i elektronegativitet er null eller veldig liten. Molekylene nevnt ovenfor: i2, ENTEN2 og n2 De presenterer ikke -polare kovalente bindinger. Derfor er elektroner rundt begge atomene med samme frekvens.
Det kan tjene deg: uretan: struktur, egenskaper, innhenting, brukEksempler på kovalente lenker
Til slutt vil andre kovalente obligasjoner bli oppført i tillegg til de som allerede er forklart, og indikerer også deres typer:
H2S (H-S-H), enkel polar kovalent | HCl (H-CL), Polar Simple Covalent Link |
H2 (h-h), ikke polar enkel kovalent | C2H4 (H-C≡C-H), med to enkle polare lenker (C-H) og en trippel ikke-polar lenke (C≡C) |
F2 (f-f), enkel ikke-polar kovalent | P2 (p≡P), ikke -polar (eller apolar) kovalent binding |
Co₂ (o = c = o), dobbel polar kovalent | S2 (S = S), ikke -polar dobbeltkovalent binding |
HCN (H-C≡N), med en enkel polar kovalent binding (H-C), og en annen trippel polar lenke (C≡N) | NH3 (N-H), med tre enkle polare kovalente bindinger |
De siterte eksemplene tilsvarer små molekyler. Men kovalente bindinger er til stede i alle eksisterende molekyler, inkludert polymerer, biomolekyler, makromolekyler, mineraler, keramikk, hydrokarboner, blant mange andre.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- María Estela Raffino. (28. juni 2020). Kovalent binding. Konsept.av. Gjenopprettet fra: konsept.av
- Wikipedia. (2020). Kovalent binding. Hentet fra: i.Wikipedia.org
- Camy Fung & Nima Mirzaee. (15. august 2020). Kovalente bindinger. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (27. august 2020). Hva er en kovalent bånd i kjemi? Gjenopprettet fra: Thoughtco.com

