Hydrogenbro -kobling
- 2196
- 181
- Marius Aasen
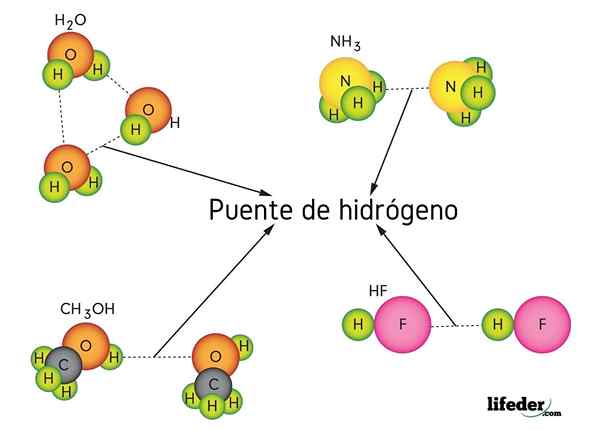
 Hydrogenbro i vann (h2O), metanol (Cho3Å), hydrogenfluorid (HF) og ammoniakk (NH3)
Hydrogenbro i vann (h2O), metanol (Cho3Å), hydrogenfluorid (HF) og ammoniakk (NH3) Hva er en hydrogenbro -kobling?
Hydrogenbro-bindingen er en spesiell type dipol-dipolo-interaksjon, som tilhører van der Waals-kreftene, der et hydrogenatom blir sammen med to eller flere molekyler uten å være kovalent koblet. Det er ingen snakk om et elektronrom, men av et hovedsakelig elektrostatisk fenomen.
Som navnet antyder, fungerer hydrogen som en bro, så det må være mellom to atomer. Hydrogen er koblet (H-X) til et veldig elektronegativt atom (for eksempel N, O og F), og nærmer seg et annet elektronegativt atom, men fra et nabomolekyl. Dette resulterer i dannelsen av hydrogenbroen x ··· h-x.
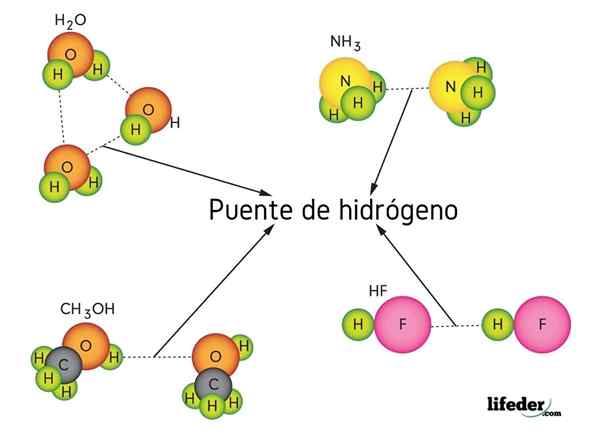
Legg merke til at i X ··· H-X-representasjon symboliserer punktene hydrogenbroen, mens skriptet representerer den kovalente bindingen mellom H og X. Når det er sagt, la oss se på hydrogenbroen mellom to vannmolekyler, der x er oksygenatom: h2Eller ··· H-oh (lavere bilde).
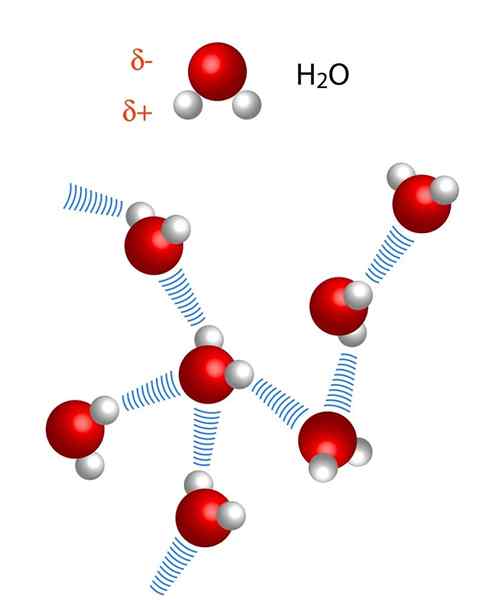
På bildet over ser vi at syv vannmolekyler forblir sammen takket være deres hydrogenbroer, representert med blå linjer. En hydrogenbro alene er ikke veldig sterk, men når det er milliarder av dem, gir de saken unormale og uventede egenskaper.
Kjennetegn på hydrogenbroen
Komposisjon
Hydrogenbroen skal virkelig være representert som X '··· H-X, der X er det som er kjent som hydrogenbro-donoren, fordi den er kovalent koblet til hydrogen (den gir den).
I mellomtiden er x 'akseptor for hydrogenbroen, til stede i et nabomolekyl (mottar det). Dermed har vi et giveratom (x), et hydrogen (H) og et akseptoratom (x ') som komponerer hydrogenbroen (x' ··· h-x).
Geometrisk
Når vi tenker på en bro, kommer flate eller buede overflater til tankene. Fordi det antas at koblingene ikke kurver, vil vi da ha to avstander: x ··· h og h-x, som utgjør hydrogenbroen x ··· h-x.
Kan tjene deg: irreversibel reaksjon: Kjennetegn og eksemplerMellom disse to avstandene er det en vinkel, som ofte er 180 °; Det vil si at de tre atomene i broen vår hviler på den samme horisontale (eller vertikale) linjen.
Når vinkelen er forskjellig fra 180º, er X ··· H-X-broen ikke lenger rett eller lineær, men skaffer seg andre geometrier.
På den annen side er avstander i hydrogenbroer ikke identiske. H-X-avstanden er kortere enn x ··· h, som kan sees i bildet av vannmolekyler. Dermed er for eksempel H-X-avstanden vanligvis 110 pm (1 · 10-12m), mens den andre avstanden x ··· t er 160 pm og utover.
Assosiativ
Et spesielt kjennetegn ved hydrogenbroen er at den lar molekylene være mye mer forbundet med hverandre. De går ikke fra side til en annen som ignorerer hverandre. Derfor etablerer den en øyeblikkelig orden i brystene av væsker; Og når det gjelder faste stoffer, bidrar de til definisjonen av krystaller.
Der vi ser en hydrogenbro, kan vi tenke på assosiasjon og derfor i en viss rekkefølge (selv om dynamisk og skiftende) til molekylære skalaer.
Energi
Å bryte en hydrogenbro er ikke veldig vanskelig. Vannmolekyler, for eksempel, gå og skape hver gang mens du mobiliserer. Men å bryte mange av dem samtidig ville innebære å forstyrre et uendelig antall molekyler. Vi snakker om å levere en slik energi som bryter mol av disse hydrogenbroene (6.02 · 1023 X ··· H-X).
Dermed varierer kraften til hydrogenbroen avhengig av identiteten og arten av molekylene. For eksempel er kraften til hydrogenbroen eller ··· H-O mellom vann og alkohol 5 kcal/mol: 5 kcal av energi er nødvendig for å bryte en mol av den hydrogenbroen det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det gjelder det aktuelle hydrogenbroen det gjelder.
Kan tjene deg: Kjemiske endringer: Kjennetegn, eksempler, typerEksempler på hydrogenbroer
Vann
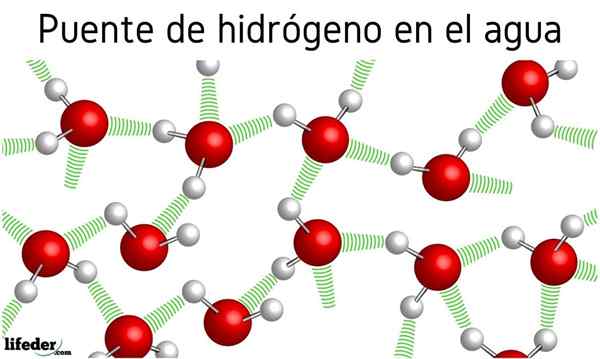
Først var det snakk om hydrogenbroer mellom vannmolekylene, men effekten det har på egenskapene deres ble ikke nevnt. Takk til dem koker vannet ved 100 ° C, og etterlater kokepunktene til beslektede molekyler som H2S, som koker ved -60 ºC; eller h2Jeg vet, koke ved -41.25 ºC.
Denne avgrensede forskjellen skyldes vannhydrogenbroer, som også definerer andre av deres anomale egenskaper, for eksempel deres enorme spesifikke varme, iskrystaller, deres dielektriske konstant, etc.
Etanol
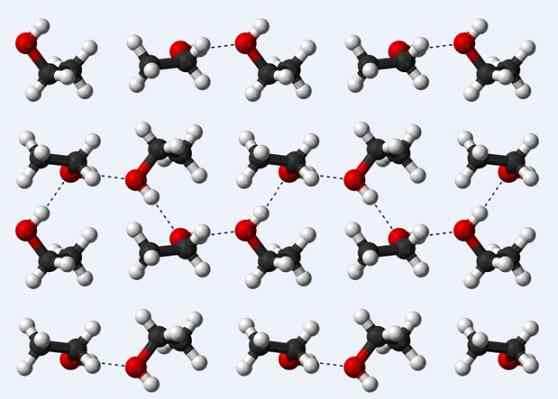 Hydrogen broer i en etanolkrystall
Hydrogen broer i en etanolkrystall La oss nå se en annen hydrogenbro: den mellom etanolmolekyler, CH3Ch2Å (over). Legg merke til hvordan molekylene er innkvartert3Ch2Å på en slik måte at hydrogenbroene deres er etablert3Ch2Ho ··· Hoch2Ch3 (stiplede linjer).
Imidlertid er molekylene for beordret til å anta at vi snakker om flytende etanol, men i stedet utgjør et glass (solid etanol).
Hydrogenbroen som er beskrevet for etanol ligner den for de andre alkoholene, med forskjellen at deres kullsyreholdige skjeletter kan hindre effektiviteten til nevnte broer.
Eddiksyre
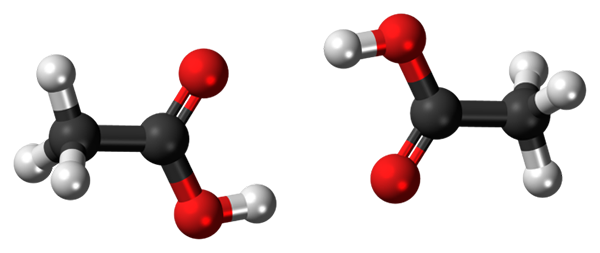 Hydrogenbroer mellom to eddiksyremolekyler. Kilde: Jynto, CC0, via Wikimedia Commons
Hydrogenbroer mellom to eddiksyremolekyler. Kilde: Jynto, CC0, via Wikimedia Commons Eddiksyre, cho3Cooh, er i stand til å etablere to hydrogenbroer som forener to molekyler samtidig. Fordi de er to molekyler koblet av hydrogenbroene, snakker vi om en dimer.
Merk at en av disse hydrogenbroene er C = O ··· H-O og den andre O-H ··· O = C. Eddiksyre presenterer særegenheten at den i dampfasen eksisterer som denne dimeren.
Det kan tjene deg: mangan eller permangansyreCellulose
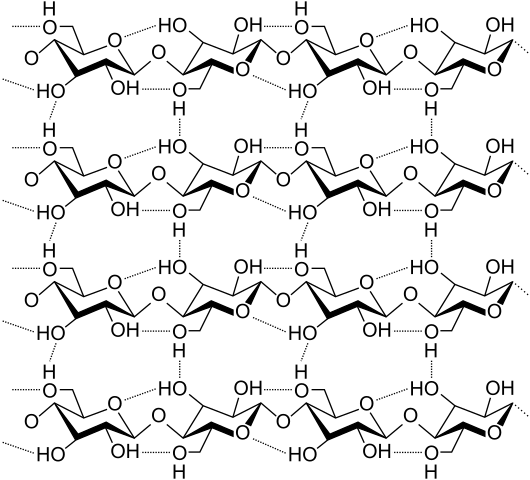 Hydrogenbroer mellom flere cellulosekjeder. Kilde: Laghi.L, CC By-SA 3.0, via Wikimedia Commons
Hydrogenbroer mellom flere cellulosekjeder. Kilde: Laghi.L, CC By-SA 3.0, via Wikimedia Commons La oss nå se mer mangfoldige og flere hydrogenbroer. Cellulose, en naturlig polymer, består av kjeder sammensatt av flere enheter av ß-glukose.
Hver kjede forblir fast til en annen takket være mange hydrogenbroer (overlegen bilde), som forsterker samholdet mellom kjedene.
DNA
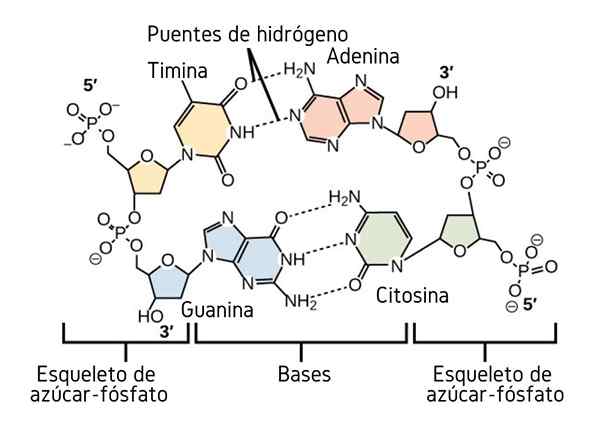 Hydrogenbroer mellom nitrogenbasene til DNA. Kilde: CNX Openstax, CC av 4.0, via Wikimedia Commons
Hydrogenbroer mellom nitrogenbasene til DNA. Kilde: CNX Openstax, CC av 4.0, via Wikimedia Commons Så langt har vi sett den assosiative effekten av hydrogenbroer for å innføre orden mellom molekylene. Men hva med et makromolekyl? I et makromolekyl, som DNA, finner vi indre eller intramolekylære hydrogenbroer mellom dets tymin, adenin, guanin og cytosin (over) base (over).
Intramolekylær hydrogenbroer mellom disse nitrogenbaseparene, få DNA -molekylet til å skaffe seg en dobbel propellstruktur, noe som er ideelt for replikasjonen. Hvis disse hydrogenbroene brytes ved oppvarming, vil den doble propellen ende opp med å åpne i to individuelle segmenter eller bånd.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Edward e. Ávila & Asilé J. bjørnebær. (2004). Hydrogenbroen og dens applikasjoner lenker. University of Los Andes, Fakultet for vitenskap, avdeling for kjemi.
- Wikipedia. (2020). Hydrogenbinding. Hentet fra: i.Wikipedia.org
- Pietri J. & Clark J. (21. august 2020). Hydrogenbinding. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Redaktørene av Enyclopaedia Britannica. (2020). Hydrogenbinding. Gjenopprettet fra: Britannica.com
- Helmestine, Anne Marie, PH.D. (29. oktober 2020). Hva er eksempel på hydrogenbinding? Gjenopprettet fra: Thoughtco.com

