Acid-Bases Arrhenius, Bronsted-Lowry Teorier, Lewis

- 3633
- 510
- Jonathan Carlsen
 Graf som relaterer de tre hovedteoriene om syrer og baser. Kilde: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons
Graf som relaterer de tre hovedteoriene om syrer og baser. Kilde: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons Hva er syre og base teorier?
Syre- og base -teorier er et sett med konseptuelle bidrag som definerer og differensierer syrer og baser, to konglomerater av enorme relevansstoffer innen kjemi.
Røttene kommer fra de første karakteriseringene som ble gjort av Robert Boyle i 1661, som definerte syrer som sure og etsende stoffer som endrer fargen på det blå til røde fjærpapiret; Og basene som såpestoffer som, i motsetning til syrer, endrer fargen på det røde til blå skinnpapir.
Antoine Lavoisier foreslo at alle syrer inneholder oksygenatomer, for eksempel H2SW4 og hno3. Århundrer senere i 1811 fant Humphry Davy at mange syrer faktisk ikke hadde oksygenatomer, som HCl, HF, HBR, etc.
Og kort tid før utseendet til den berømte syre-base-triaden (overlegen bilde), antydet Justig Liebig at syrer har hydrogenatomer som kan erstattes av metallkationer.
Denne empiriske kunnskapen fungerte som inspirasjon for de nåværende teoriene om syrer og baser: Arrhenius, Bronsted-Lowry og Lewis. Som det fremgår av grafen, er Arrhenius teori den mest restriktive eller begrensede av alle, mens Lewis er den mest generelle og globaliserte.
Arrhenius teori
Foreslått av 1884 av Svante Arrhenius, sier teorien hans at syrer når de ble oppløst i vannproduserer ioner h3ENTEN+ eller h+; Mens basene, når du løses opp i vann, produserer eller slipper OH -ioner-.
Ionene h3ENTEN+ Og åh- De kombineres i en reversibel reaksjon som gir opphav til vannmolekyler:
H3ENTEN+ + Åh- ⇌ 2H2ENTEN
Kan tjene deg: disulfurinsyre: hva er, struktur, egenskaper, brukSå en Arrhenius -syre er også den som øker konsentrasjonen av H -ioner3ENTEN+, Mens en Arrhenius -base er en som øker ionekonsentrasjonen OH-.
Dette betyr at en Arrhenius -syre ikke nødvendigvis skal inneholde H -ioner3ENTEN+, Og en Arrhenius -base trenger ikke å ha OH -ioner- I sin struktur.
Eksempel og begrensninger
Tenk på følgende dissosiasjoner:
HCl (AC) → H+(AC) +CL-(AC)
NaOH (AC) → Na+(AC) +OH-(AC)
HCl er en Arrhenius -syre fordi når den blir oppløst i vann produserer den H -ioner+, eller mer korrekt, H -ioner3ENTEN+. Og på den annen side er Naoh en Arrhenius -base fordi når den er oppløst i vann, frigjør Oh -ioner-. Disse stoffene reagerer på hverandre for å produsere salt og vann:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2ENTEN
Problemet med Arrhenius -teorien ligger i det faktum at den bare er begrenset til vandige oppløsninger, og gjelder derfor bare for stoffer som er oppløselige i vann. For eksempel er MGO veldig uoppløselig i vannet, og likevel er det et grunnleggende oksid.
Det er heller ikke i stand til å forklare seg selv hvordan stoffer som NH3 og Cao produserer OH -ioner- oppløst i vann, selv når de ikke har ioner oh- I sin molekylære eller krystallinske struktur (som tilfellet er NaOH eller KOH).
Og han forklarer ikke hvordan CO2 kan frigjøre ioner h3ENTEN+ I vann uten å ha noe hydrogenatom i sin molekylære struktur (som tilfellet er med HCl eller H2SW4).
Brönsted-Lowry Theory
Forslag individuelt i 1923 av Johannes Bronsted og Thomas Lewry, deres teori om syrer og baser sier at en syre er alt det stoffet som kan donere ioner h+, og at en base i stedet er ethvert stoff som er i stand til å akseptere disse h+. Denne teorien er mer generell enn Arrhenius og dekker flere av dens begrensninger.
Kan tjene deg: Molar Solutions: Concept, Preparation, EksemplerEksempel
Tenk på nøytraliseringsligningen mellom H igjen3ENTEN+ Og en åh- Å produsere to vannmolekyler:
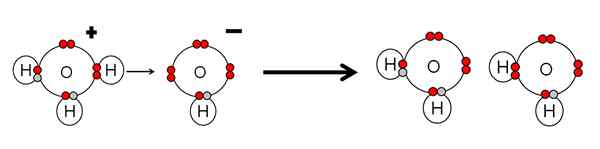 Eksempel på syre nøytralisering og vannbase. Kilde: Gabriel Bolívar.
Eksempel på syre nøytralisering og vannbase. Kilde: Gabriel Bolívar. Merk at h3ENTEN+ Gjort en h+ som umiddelbart vil bli koblet eller koordinert med OH- Høyre rett. Når h+ Det ender knyttet til et av de elektronfrie parene i OH-, To nøytrale vannmolekyler forblir som produkter.
H3ENTEN+ Derfor er det en Brnsted-lavesyre, for å donere H+, Og OH- Det er en Brnsted-lavbase for å godta denne H+.
Et annet eksempel på en syre-base-reaksjon er som følger:
NH3(g) + HCl (g) → NH4CL (S)
Denne reaksjonen, ifølge Arrhenius, kunne ikke betraktes som syre-basetypen fordi den ikke foregår i vandig medium, men i dampfasen eller i en gassformig tilstand. NH3 Det er en Brnsted -base fordi den aksepterer HCl H ved å donere et par elektroner som ligger på nitrogenatomet; Og HCl, logisk, blir den Brnsted -syren.
Dermed er MGO en Brnsted -base fordi den er i stand til å akseptere H+ av syrer for å transformere til MG (OH)2.
Lewis Theory
Bronsted-Lowrys teori forklarer et bredt spekter av syre-base-reaksjoner. Ignorer imidlertid de reaksjonene der H -ioner+ Og åh- De er ikke involvert i det hele tatt, samt en større deltakelse av frie elektroner i molekylære mekanismer.
Dermed, i 1923 g. N. Lewis foreslo en syre-base-teori som sier følgende: en syre er ethvert stoff som er i stand til å akseptere par elektroner, mens en base er en som donerer disse elektronparene.
Det kan tjene deg: DAPI (4 ', 6-Diamidino-2-Fenylindol): Kjennetegn, foundation, brukFor eksempel ion h+ Det er en Lewis -syre fordi den godtar elektronpar av noen arter rundt: fra H2Eller å opprinnelig h3ENTEN+, av NH3 Å stamme NH4+, etc.
Eksempel og fordeler
Tenk på et annet eksempel i følgende reaksjon:
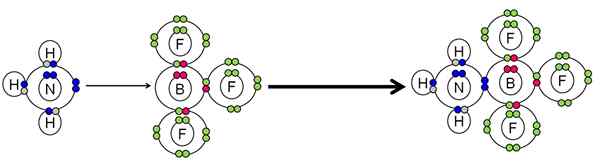 Eksempel på nøytralisering mellom en syre og en Lewis -base. Kilde: Gabriel Bolívar.
Eksempel på nøytralisering mellom en syre og en Lewis -base. Kilde: Gabriel Bolívar. NH3 Gjort et par elektroner (blått) av nitrogenatomet til BF -boratom3. Derfor NH3 Det er basen til Lewis fordi donerer paret med elektroner, og BF3 Det er Lewis syre fordi han aksepterer dem.
Generelt er kationer og dårlige elektronarter Lewis -syrer, mens anioner og elektron -rike arter er Lewis -baser.
Fordelene som tilbys.
For eksempel: h2O Den har gratis elektroner i oksygen. Hvis du donerer en av dem til et ion h+, vil fungere som en Lewis -base, være h+ Følgelig Lewis syre.
I følge Bronsted-Lowry, h2Eller jeg vil opptre som base fordi det nettopp aksepterer h+ Ved å donere et par av sine gratis elektroner. Og til slutt, h2Eller det er også en base i henhold til Arrhenius teori fordi konsentrasjonen av H -ioner avtar+ i det vandige miljøet, og øker følgelig konsentrasjonen av OH -ioner-.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Clark Jim. (2002). Teorier om syrer og baser. Gjenopprettet fra: Chemguide.co.Storbritannia
- Broderick c., Moussa m., & Clark J. (21. august 2020). Oversikt over syrer og baser. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Wikipedia. (2020). Syre-basereaksjon. Hentet fra: i.Wikipedia.org
- Texas A&M University. (s.F.). Syrer og baser: utvikling av syrer og baser. Gjenopprettet fra: Chem.tamu.Edu

