Reaksjon entalpi, termokjemi, øvelser

- 3469
- 896
- Jonathan Moe
De Reaksjon entalpi Det er en termodynamisk funksjon som lar deg beregne varmen som er oppnådd eller levert til en kjemisk reaksjon, forutsatt at denne reaksjonen har skjedd ved konstant trykk. Det er definert som indre energi eller pluss produktet av trykket P i volum V av stoffene som er involvert i en kjemisk reaksjon, som følger: H = U + P ∙ V
Derfor har entalpi dimensjoner av energi, og i det internasjonale tiltakesystemet måles det i joules. For å forstå forholdet mellom entalpi og varmen som er utvekslet i en kjemisk reaksjon, er det nødvendig å huske den første loven om termodynamikk, som fastslår følgende: q = ΔU + w
 Figur 1. I forbrenningen av en gass reduseres entalpien. Kilde: Pixabay
Figur 1. I forbrenningen av en gass reduseres entalpien. Kilde: Pixabay Den første loven slår fast at varmen som ble utvekslet i en termodynamisk prosess er lik variasjonen av den indre energien til stoffene som er involvert i prosessen pluss arbeidet som er utført av disse stoffene i prosessen.
I enhver prosess beregnes W -arbeid ved følgende forhold:

I det forrige uttrykket VI er det opprinnelige volumet, VF det endelige volumet og P trykket. Hvis prosessen utføres under konstant trykk P, vil det resulterende arbeidet være:
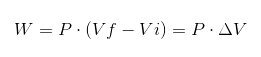
Hvor ΔV er volumvariasjonen.
[TOC]
Definisjon
Kjemiske reaksjoner er termodynamiske prosesser som generelt oppstår under konstant trykk og veldig ofte ved atmosfæretrykk. Denne typen termodynamiske prosesser kalles "isobarisk", siden den oppstår ved konstant trykk.
I dette tilfellet kan den første loven om termodynamikk skrives slik:
QP = ΔU + P ∙ ΔV
Der QP indikerer at det er utvekslet varme med konstant trykk. Hvis definisjonen av entalpi h = u + p ∙ v oppnådd da:
QP = ΔH
Derfra må du endre positiv entalpi indikerer en reaksjon som har tatt varme fra miljøet. Dette er en endotermisk reaksjon.
Kan tjene deg: tonn: transformasjoner, ekvivalenser og øvelser løstTvert imot, hvis endring av entalpi er negativ, er det en eksoterm reaksjon.
Faktisk kommer ordet entalpi fra det greske ordet Enthalpien, hvis betydning er "varme".
Ofte kalles entalpien også varme. Men det må være klart at det ikke er det samme som varme, men det er utveksling av varme under den termodynamiske prosessen som endrer entalpien.
Varmeforhold
I motsetning til varme, er entalpi en tilstandsfunksjon. Når endring av entalpi beregnes, beregnes forskjellen mellom to funksjoner som utelukkende er avhengig av statusen til systemet, for eksempel intern energi og volum.
ΔH = ΔU + P ∙ ΔV
Som i reaksjonen forblir trykket konstant, så reaksjonsentalpien er en tilstandsfunksjon som bare avhenger av indre energi og volum.
I en kjemisk reaksjon kan reagensens entalpi defineres som summen av hver av dem; og produkter som summen av entalpien til alle produkter.
Endringen av entalpi i en reaksjon er forskjellen på produktene bortsett fra reagensene:

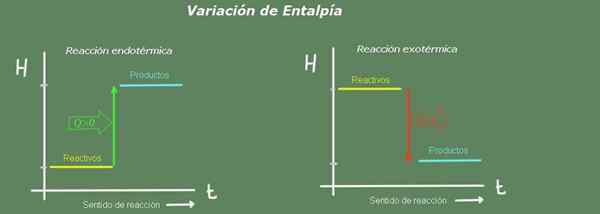 Figur 2. Enthalpy Diagram. Kilde: Selvlaget.
Figur 2. Enthalpy Diagram. Kilde: Selvlaget. I en endotermisk reaksjon er produktets entalpi større enn reagensene; det vil si at reaksjonen tar varme fra miljøet. Tvert imot, i en eksotermisk reaksjon er reagensens entalpi større enn produktene, siden reaksjonen gir varme til miljøet.
Standard entalpi
Siden endring av entalpi i en kjemisk reaksjon kan avhenge av trykk og temperatur, er det vanlig å definere standardreaksjonsbetingelsene:
Det kan tjene deg: Kalibreringskurve: Hva er det for, hvordan du gjør det, eksemplerStandard reaksjonstemperatur: 25 ° C.
Standard reaksjonstrykk: 1 atm = 1 bar.
Standard entalpi er betegnet som følger: H °
Termokjemi
I en termokjemisk ligning betyr ikke bare reagenser og produkter, variasjonen av entalpi betyr også noe. Enthalpy forstås som reaksjonen på endringen av henne som hadde plass under det samme.
La oss som et eksempel se følgende reaksjoner:
2 H2 (gass) + O2 (gass) → 2 H2O (væske); ΔH ° = -571,6 kJ (eksoterm).
H2 (gass) + (½) O2 (gass) → H2O (væske); ΔH ° = -285,8 kJ (Exotermisk).
2 H2O (væske) → 2 H2 (gass) + O2 (gass); ΔH ° = +571,6 kJ (endotermisk).
Enthalpy er en omfattende termodynamisk mengde
Hvis vilkårene for en kjemisk ligning multipliseres eller deles med en viss faktor, blir entalpien multiplisert eller delt på den.
Hvis reaksjonen er investert, blir også tegnet på reaksjons entalpien investert.
Løste øvelser
-Oppgave 1
C2H2 acetylengass oppnås fra CAC2 kalsiumkarbidreaksjon som kommer på en granulert måte med vann i miljø og miljøtrykk.
Som data er det entalpier av reagensdannelse:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
Og entalpien av produktdannelse:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Finn standard entropi av reaksjonen.
Løsning
Den første tingen er å heve den balanserte kjemiske ligningen:
CAC2 (S) + 2H20 (L) → Ca (OH) 2 (s) + C2H2 (G)
Og nå er entalpiene til reagensene, produktene og reaksjonen:
- Reagenser: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Produkter: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Det kan tjene deg: Hva er Coplanares -vektorer? (Med løste øvelser)- Reaksjon: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Det er en eksotermisk reaksjon.
-Oppgave 2
Når 1 liter acetylen brenner under standardbetingelser, hvor mye varme løsner det?
Løsning
Forbrenningsreaksjonen av acetylen når den er balansert er slik:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (L)
Vi trenger entalpier av produktopplæring:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Beregning av entalpier
Med disse dataene kan vi beregne entalpien til produktene:
ΔH ° (produkter) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
Og reagensdannelses entalpi:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Reagensens entalpi vil være:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Den molare reaksjonsentalpien vil da være: ΔH ° (produkter) - ΔH ° (reagenser) = -1072,8KJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol
Forbrenning entalpi
Nå må vi vite hvor mange mol acetylen som er en liter acetylen under standardtilstander. For dette vil vi bruke tilstandsligningen til en ideell gass, hvor vi vil fjerne antall føflekker.
Antall føflekker n = p*v/(r*t)
P = 1 atm = 1.013 x 10⁵ PA
V = 1 l = 1,0 x 10^-3 m³
R = 8,31 j/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
Forbrenningens entalpi av 1 liter acetylen er 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Det negative tegnet indikerer at det er en eksoterm reaksjon som avgir 53,13 kJ = 12,69 kcal.
Referanser
- Castaños e. Entalpi i kjemiske reaksjoner. Gjenopprettet fra: lidiaconlachimica.WordPress.com
- Termokjemi. Reaksjon entalpi. Hentet fra: Ressurser.utdanning.er
- Termokjemi. Definisjon av standard reaksjonsentalpi. Gjenopprettet fra: Quimitube.com
- Wikipedia. Standard reaksjon entalpi. Gjenopprettet fra: Wikipedia.com
- Wikipedia. Trening entalpi. Gjenopprettet fra: Wikipedia.com
- « Relative feilformler, hvordan det beregnes, øvelser
- Hva er oppdragsinnsatsen og hvordan du kan få den? »

