Kjemisk balanseforklaring, faktorer, typer, eksempler

- 4628
- 229
- Markus Fredriksen
Han Kjemisk balanse Det er en tilstand som når de reversible kjemiske reaksjonene der ingen variasjon av konsentrasjoner, eller reagenser, heller ikke av de involverte produktene. Det er preget av å være dynamisk og ikke statisk; det vil si at molekylene eller atomene fortsetter å reagere, men opprettholder de samme konsentrasjonene i løpet av tiden.
En lignende balanse er også presentert i faseendringer, selv om det ikke er noen koblingspauser. For eksempel kan en væske være i balanse med damper, så vel som et faststoff. På samme måte etablerer et fast stoff en balanse med vannet som omgir det når det har utfelt eller krystallisert.
 I den kjemiske industrien er kunnskap om den kjemiske balansen viktig for å oppnå syntese med bedre utbytte. Kilde: Pxhere.
I den kjemiske industrien er kunnskap om den kjemiske balansen viktig for å oppnå syntese med bedre utbytte. Kilde: Pxhere. Når den kjemiske balansen er etablert, er det ikke mulig å få flere endringer eller svar med mindre den blir avbrutt eller påvirket av eksterne handlinger. Det er således i syntesen av et produkt.
Ellers i balanse vil mengden av produkter være utilfredsstillende; det vil si at det vil være dårlig reaksjonsytelse. Det er grunnen til at den kjemiske balansen er viktig for den kjemiske industrien, og generelt for enhver syntese uavhengig av skalaen.
I kjemisk balanse kan det være flere produkter, eller flere reagenser. Alt avhenger av hvor balansen er fortrengt. Når du tar hensyn til flere faktorer, kan du flytte en balanse mot hvilken som helst av de to retningene til den doble pilen i den reversible reaksjonen.
[TOC]
Forklaring av kjemisk balanse
Før balanse
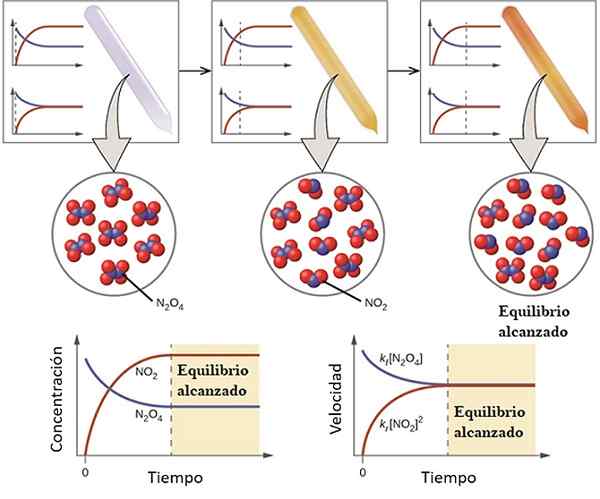 Eksempel på hvordan en reaksjon nærmer seg balansen. Kilde: OpenStax/CC av (https: // creativeCommons.Org/lisenser/av/4.0)
Eksempel på hvordan en reaksjon nærmer seg balansen. Kilde: OpenStax/CC av (https: // creativeCommons.Org/lisenser/av/4.0) Å forstå hva den kjemiske balansen er vurderer følgende reversible reaksjoner:
N2ENTEN4(g) ⇌ nei2(g)
Gassen n2ENTEN4 Det er fargeløs, mens gassen ikke gjør det2 presenterer en brun eller brun farge. Hvis en spesifikk mengde n blir injisert i et lite hetteglass eller beholder2ENTEN4, Dette vil være fargeløst til balansen er etablert.
Til venstre for det øvre bildet kan det sees at nesten alle molekylene er av n2ENTEN4 og at konsentrasjonen av NO2 Det er null.
Vis også to grafer som representerer hvordan trenden i balansen er, med den stiplede linjen som peker posisjonen på det tidspunktet at bare n blir injisert2ENTEN4. En graf tilsvarer konsentrasjon vs. Tid (nede) og den andre tilsvarer grafen med hastighet Vs. Tid (ned høyre hånd).
Konsentrasjonen av n2ENTEN4, [N2ENTEN4] (blå linje) vil gradvis avta, siden en del av den vil dissosiere for å produsere molekyler av NO2. Dermed å være konsentrasjonen av NO2, [NEI2] (rød linje) lik null i begynnelsen, vil snart øke som n2ENTEN4 Dissosiate.
Imidlertid er det en reversibel reaksjon: en del av ingen molekyler2 De vil bli med for å danne n2ENTEN4. Det vil derfor være to reaksjoner, direkte og inverse, hver med sine egne hastigheter.
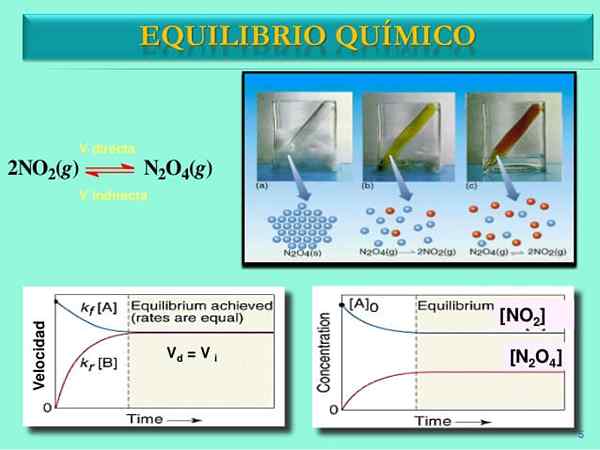 Kilde: Slideshare.nett
Kilde: Slideshare.nett Reaksjonshastigheter
Til å begynne med forbrukshastigheten til n2ENTEN4 er større enn forbrukshastigheten til NO2. Åpenbart å ha bare n2ENTEN4, de få molekylene dannet av NO2 De kan knapt finne seg i å reagere. På dette tidspunktet vil hetteglasset begynne å prikke oransje, fordi det er en blanding av n2ENTEN4 og ikke2.
Litt etter litt, ettersom det er flere molekyler av nei2 I veien og at N -molekylene2ENTEN4 De dissosierer, hastighetene til de to reaksjonene vil samsvare, selv om konsentrasjonene er forskjellige fra hverandre. Det vil si nei2] har en tendens til å være større enn [n2ENTEN4], og det er grunnen til at den røde linjen er over den blålige linjen.
Kan tjene deg: fysisk -kjemiske egenskaperMerk at hastigheten blir DC/DT, det vil si konsentrasjonsendringen med hensyn til tid. Det er grunnen til at de to C vs. t og V vs. t er ikke identiske.
I balanse
Når paret n2ENTEN4-NEI2 Angi balansen, hastighetene til begge reaksjonene vil bli matchet, og følgende matematiske uttrykk vil bli oppnådd:
Vdirekte = k1[N2ENTEN4]
Vomvendt = k-1[NEI2]2
Vdirekte = Vomvendt
k1[N2ENTEN4] = k-1[NEI2]2
k1/k-1 = [Nei2]2/ [N2ENTEN4]
KEq = [Nei2]2/ [N2ENTEN4]
På dette tidspunktet vil veien bli farget enda mer enn brun, siden balansen er mer fortrengt mot dannelsen av [nei2]. Det vil si kEq, Likevektskonstanten må være større enn 1 under hensyntagen til det høyere forholdet, [nei2]2/ [N2ENTEN4].
I balansekonsentrasjoner [n2ENTEN4] og ikke2] De forblir konstante, med begge reaksjonene som skjer i samme hastighet: en viss mengde n er bare dissosiert2ENTEN4, Det samme beløpet vil bli produsert umiddelbart på grunn av reaksjonen fra en viss mengde NO2.
Av denne grunn sies det at den kjemiske balansen er dynamisk: molekylene n2ENTEN4 og ikke2 De deltar fortsatt i reaksjoner selv når det ikke er noen endring i konsentrasjonene.
Og å være like reaksjonshastigheter for begge sanser, den røde og blålige linjen i grafikken V vs. T Spill på en horisontal linje.
Likevektskonstant
Likevektskonstanten for den forrige reaksjonen vil alltid være den samme, ved en viss temperatur, uavhengig av hvor mye n2ENTEN4 injiseres i begynnelsen av veien. Dette vil være slik selv om en blanding av N blir direkte injisert2ENTEN4 og ikke2, deretter igjen i ro til balansen når.
Når balansen er nådd og konsentrasjoner måles [n2ENTEN4] og ikke2], forholdet [nei2]2/ [N2ENTEN4] vil gi det samme til KEq For denne reaksjonen. Jo større det er (keq >> 1), jo flere produkter vil det være i balanse. Og de mindre (keq << 1), más reactivos habrá en el equilibrio.
Konsentrasjoner [n2ENTEN4] og ikke2] De vil ikke alltid. For eksempel, hvis små volumer blir injisert i hetteglasset, eller hvis tvert imot blir injisert torrenter av disse gassene i en reaktor, vil mengdene variere betydelig. Imidlertid kEq Det vil forbli den samme så lenge temperaturen er den samme i begge prosesser.
KEq Det er utsatt for temperaturendringer: Ved en høyere temperatur vil større verdi være. Det vil si ved en høyere temperatur, i balanse vil det ha en tendens til dannelsen av flere produkter. Dette er slik med mindre reaksjonen er eksotermisk, som vil bli forklart i følgende avsnitt.
Faktorer som påvirker kjemisk balanse
Faktorene som påvirker den kjemiske balansen i en reversibel reaksjon er: konsentrasjon, trykk og temperatur.
- Konsentrasjon
I en reversibel reaksjon, i henhold til Le Chatliers prinsipp, vil det ved å øke konsentrasjonen av et reagens være en forskyvning av den kjemiske balansen til høyre for å øke konsentrasjonen av reaksjonsproduktene.
Tvert imot, hvis et produkt blir lagt til reaksjonen, vil den kjemiske balansen bevege seg til venstre for å øke konsentrasjonen av reagensene. Hvis følgende reaksjon blir tatt som et eksempel:
C (S) +O2(g) ⇌ 2 CO (g)
Ved å øke konsentrasjonen av reagensene (C og O2), Vil balansen bevege seg til høyre, det vil si mot dannelsen av karbonmonoksid (CO) -produktet (CO). Men en økning i konsentrasjonen av Ca vil gi en forskyvning av balansen til venstre for å øke konsentrasjonen av C og O2.
Det kan tjene deg: karbonylgruppe: egenskaper, egenskaper, nomenklatur, reaktivitet- Press
I en reaksjon utviklet i gassfasen vil en variasjon i volumet eller i trykket som utøves på gassene som er involvert i den, gi en endring i balansen, avhengig av antall mol av reagensene og produktene.
Hvis komponentene i en reaksjon (reagenser og produkter) har forskjeller i antall føflekker som er involvert i en reaksjon, for eksempel dimerisering av nitrogendioksid (nei2):
2 nei2(g) ⇌2ENTEN4(g)
En økning i trykket som utøves på reaksjonen i en gassfase, en konsekvens av en reduksjon eller ikke av reaksjonsvolumet, vil føre til en forskyvning av den kjemiske balansen på siden som har mindre gassmohese. I dette eksemplet: Produkt n2ENTEN4.
Tvert imot, en reduksjon i trykk vil gi en forskyvning av balanse til siden av reaksjonen som har det største antallet mol gass. I det gitte eksemplet vil det bevege seg mot reagensene (nei2), For å motvirke reduksjonen i trykk.
Hvis molene til reagensene er i en brus -reaksjon, er lik molene til produktene, vil endringene i trykket ikke påvirke den kjemiske balansen.
- Temperatur
Endoterm reaksjon
I en endoterm reaksjon kan varme betraktes som et reagens, siden tilførselen er nødvendig for at reaksjonen skal oppstå:
A +Q ⇌ B
Q = levert varme
Derfor, i en endotermisk reaksjon når temperaturen øker, vil balansen bevege seg til høyre. I mellomtiden, når temperaturen avtar, beveger balansen seg til venstre.
Varmen er en del av reagensene, for å konsumere den for å transformere seg til B.
Eksoterm reaksjon
I en eksoterm reaksjon genereres varme, dette er et produkt av reaksjonen:
A ⇌ B +Q
I en eksoterm reaksjon når temperaturen øker, vil balansen bevege seg til venstre (reagenser), siden varmeproduksjonen øker. I mellomtiden, når temperaturen avtar, vil balansen bevege seg til høyre (produkter).
Varmen er en del av produktene, når temperaturen øker vil det ikke være behov for å bidra med mer varme til miljøet. Og derfor vil balansen søke å dra nytte av ekstra varme for å produsere flere reagenser; I dette tilfellet, mer enn.
Kjemiske balansetyper
Avhengig av den fysiske tilstanden til reaksjonskomponentene, kan kjemisk balanse være homogen eller heterogen.
Homogen balanse
I denne typen balanser, alle Reagenser og produkter har samme fase eller væskestatus. For eksempel:
N2(g) +3 h2(g) ⇌ 2 nh3(g)
Her er det2, som h2 og NH3 De er gassformige stoffer.
Heterogen balanse
Eksisterer når ikke alle Reagenser og produkter har samme fase eller fysiske tilstand. For eksempel:
2 Nahco3(S) ⇌ Na2Co3(S) +CO2(g) +h2O (g)
Her har vi Nahco3 og na2Co3 som faste stoffer, og CO2 og h2Eller som gasser eller damper.
Eksempler på kjemisk balanse
Dissosiasjon av eddiksyre i vann
Eddiksyre, cho3COOH, dissosierer i vann som etablerer en balanse:
Ch3COOH (AC) + H2Eller (l) ⇌ cho3COO-(AC) + H3ENTEN+(AC)
Reaksjon hvis likevektskonstant kalles surhetskonstant.
Isomeriseringentenn av butanen
Gassen n-Butano kan isomeriseres i henhold til følgende reversible reaksjon for å produsere isomerisomeren:
Ch3Ch2Ch2Ch3(g) ⇌ cho3Ch (Ch3)2(g)
Nitrogenoksiddannelse i atmosfæren
I atmosfæren kan nitrogenoksid dannes, selv om det knapt, fra nitrogen og luftoksygen:
N2(g) + eller2(g) ⇌ 2no (g)
Det kan tjene deg: Hva er miljøet? (Beregningseksempler)KEq Fra denne reaksjonen er 2 · 10-31 ved 25 ºC, så en foraktelig mengde NO vil bli dannet.
ReaksjonentenN av sølvkomproduksjon med amonYoAc
Sølvioner, AG+, De kan fullføres med ammoniakk i henhold til følgende reversible reaksjoner:
AG+(Sol) + 2nh3(L) ⇌ [AG (NH3)2]+(sol)
Løste øvelser
Oppgave 1
Hvilken type kjemisk likevekt tilsvarer følgende reaksjon?
2nocl (g) ⇌ 2no (g) + cl2(g)
Denne reaksjonen tilsvarer en homogen likevekt, siden alle stoffene som er involvert, NOCL, NO og CL2, De er gasser.
Oppgave 2
For den samme reaksjonen ovenfra, hvilken endring i balanse kan forventes hvis trykket plutselig økte?
La oss telle molene til reagensene:
2nocl
Vi har 2 mol NOCL. La oss nå fortelle molene til produktene:
2no + Cl2
Vi har tre føflekker: to av nei, og en av CL2. Det er flere gassformige føflekker på siden av produktene. Derfor vil en økning i trykk føre til at balansen beveger seg til venstre, mot dannelsen av NOCL. På denne måten søker systemet å myke opp effekten av trykk som favoriserer dannelsen av NOCL og ikke av NO og CL2.
Øvelse 3
Anta at et betydelig volum av CL plutselig injiseres for den samme reaksjonen ovenfra2. Hva vil skje med balanse?
Når du legger til CL2 For reaktoren eller beholderen øker konsentrasjonen som et produkt av reaksjonen. Og derfor vil balansen bevege seg tilbake til venstre for å danne mer NOCL.
Oppgave 4
Hvis dissosiasjonen av NOCL ved 227 ºC har en 4 likevektskonstant på 4.5 · 10-4, Hvilken retning blir balansen fortrengt?
Igjen, å være kEq Mindre enn 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Siden det er fortrengt til venstre.
Oppgave 5
I henhold til følgende reaksjon i balanse:
[CO (åh2)6]2+(AC) +4Cl-(AC) +Q ⇌ [COCL4]2-(AC) +6H2Eller (l)
Og å vite at komplekset [co (oh2)6]2+ Det er rosa, og at komplekset er [cocl4]2- Det er blåaktig, hvilke endringer vil du forvente å se om du varmer en beholder med [CO (OH2)6]2+? Hva kan du forvente å se om jeg etter oppvarming av beholderen ville plassere den på et bad med is?
Reaksjonen er endotermisk, ettersom den absorberer varme som som et reagens. Derfor, når du varmer opp beholderen med [CO (OH2)6]2+, Balansen vil bevege seg til høyre, mot dannelsen av [COCL4]2-. En blåaktig rosa fargeendring vil være.
Deretter, hvis den blålige fargebeholderen med [COCL4]2- Den er plassert på et bad med is, reaksjonen vil nå bevege seg til venstre, mot dannelsen av CO (OH2)6]2+:
[Cocl4]2-(AC) +6H2Eller (l) ⇌ [co (oh2)6]2+(AC) +4Cl-(AC) +Q
Dette er fordi den omvendte reaksjonen er eksotermisk, og har varmen som et produkt. Derfor, når du avkjøler beholderen med [COCL4]2- Blå, komplekset [CO (OH (OH2)6]2+, Og den rosa fargen vil dukke opp igjen.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Emedical prep. (s.F.). Typer balanse. Gjenopprettet fra: emedicprep.com
- Lumen grenseløs kjemi. (s.F.). Faktorer som gir kjemisk balanse. Gjenopprettet fra: kurs.Lumenarning.com
- Wikipedia. (2020). Kjemisk balanse. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. (24. mai 2020). Equiquibrium -beregninger - Sub illustrerende eksempler. Gjenopprettet fra: Chem.Librettexts.org
- Meyers Amy. (2020). Likevekt: kjemisk og dynamisk. Studere. Gjenopprettet fra: Studie.com
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Kjemisk balanse i kjemiske reaksjoner. Gjenopprettet fra: Thoughtco.com
- « Guatemala kulturer egenskaper, tradisjoner og skikker
- Foundationelektroforese, teknikk, hva er det for, eksempler »

