Mikroskopiske skalaegenskaper, tellepartikler, eksempler
- 2022
- 610
- Anders Mathisen
De Mikroskopisk skala Det er en som brukes til å måle størrelsene og lengdene som ikke kan sees med det blotte øye og som er under millimeteret i lengde. Fra høyere til lavest, de mikroskopiske skalaene i metrisk system er:
- Millimeteret (1 mm), som er den tiendedel av en centimeter eller tusenvis av en meter. I dette er det skalaen vi har en av de største cellene i kroppen, som er eggløsningen, hvis størrelse er 1,5 mm.
 Figur 1. Røde blodlegemer er mikroskopiske skalaceller. Kilde: Pixabay
Figur 1. Røde blodlegemer er mikroskopiske skalaceller. Kilde: Pixabay - Tiendedel av en millimeter (0,1 mm). Dette er omfanget av tykkelsen eller diameteren på menneskehår.
- Mikrometeret eller mikra (1μm = 0,001 mm). I denne skalaen er plante- og dyreceller og bakterier.
Planteceller er i størrelsesorden 100μm. Dyreceller er ti ganger mindre, det er i størrelsesorden 10μm; Mens bakterier er 10 ganger mindre enn dyreceller og er i størrelsesorden 1μm.
[TOC]
Nanometrisk skala
Det er enda mindre tiltak enn den mikroskopiske skalaen, men som vanligvis ikke brukes, bortsett fra i noen spesielle sammenhenger. Neste gang vil vi se noen av de viktigste nanometriske tiltakene:
- Nanometeret (1 ηM = 0,001 μm = 0,000001 mm) er milliondelen av en millimeter. I denne skalaen er noen virus og molekyler. Virusene er i størrelsesorden 10ηm og molekylene i størrelsesorden 1ηm.
- Angstrom (1Å = 0,1ηm = 0,0001μm = 10-7mm). Dette tiltaket danner atomskalaen eller størrelsen.
- Fantometeret (1FM = 0,00001Å = 0,000001ηm = 10-12mm). Dette er omfanget av atomkjernene, som er mellom 10 tusen og 100 tusen ganger mindre enn atomet. Til tross for den lille størrelsen, konsentrerer kjernen imidlertid 99,99% av atommassen.
- Det er skalaer mindre til atomkjernen, da disse består av partikler som protoner og nøytroner. Men det er flere: disse partiklene består på sin side av mer grunnleggende partikler som kvarker.
Instrumenter for mikroskopisk observasjon
Når objektene er mellom millimeter og mikrometrisk skala (1 mm - 0,001 mm), kan de observeres med et optisk mikroskop.
Imidlertid, hvis objektene eller strukturene er mellom nanometer og angstrom, vil det være nødvendig med elektroniske eller nanoskopmikroskop.
I elektronisk mikroskopi i stedet for lyshøy energi -elektroner brukes som har mye lavere bølgelengde enn lys. Ulempen med det elektroniske mikroskopet er at det ikke er mulig.
Kan tjene deg: magnetisk sjokk: enheter, formler, beregning, eksemplerPå den annen side brukes laserlyset i nanoskopet, og det har fordelen over elektronisk mikroskopi at strukturer og molekyler kan sees og registreres i en levende celle.
Nanoteknologi er teknologien som kretsløp, strukturer, deler og til og med motorer er produsert på skalaene fra nanometeret til atomskalaen.
Mikroskopiske egenskaper
I fysikk studeres i en første tilnærming at oppførselen til materie og systemer studeres fra det makroskopiske synspunktet. Fra dette paradigmet er saken et uendelig delbart kontinuum; Og dette synspunktet er gyldig og tilstrekkelig for mange situasjoner i hverdagen.
Noen fenomener i den makroskopiske verden har imidlertid bare forklaring hvis de mikroskopiske egenskapene til saken er tatt i betraktning.
I det mikroskopiske synspunktet tas molekylære og atomstrukturen i saken i betraktning. I motsetning til den makroskopiske tilnærmingen, er det i denne skalaen en granulær struktur med hull og mellomrom mellom molekylene, atomer og til og med i disse.
Det andre kjennetegn ved det mikroskopiske synspunktet i fysikk, er at et stykke materie uansett hvor lite, er sammensatt av et stort antall partikler atskilt fra hverandre og i kontinuerlig bevegelse.
-Materie er en enorm tomhet
I en liten kake.
Det vil si at et stykke materie i den mikroskopiske skalaen er et stort tomrom med konsentrasjoner av atomer og kjerner som opptar en veldig liten brøkdel av det totale totale volumet. I denne forstand har den mikroskopiske skalaen likhet med den astronomiske skalaen.
Av makroskopiske objekter til oppdagelsen av atomet
De første kjemikaliene, som var alkymistene, innså at materialene kunne være av to typer: rene eller forbindelser. Dette nådde ideen om de kjemiske elementene.
Det kan tjene deg: Trykkgradient: Hva er det og hvordan det beregnesDe første kjemiske elementene ble oppdaget var de syv metaller av antikken: sølv, gull, jern, bly, tinn, kobber og kvikksølv. Over tid ble de oppdaget mer i den grad det ble funnet stoffer som ikke kunne dekomponere i andre.
Deretter ble elementene klassifisert i henhold til deres egenskaper og egenskaper i metaller og ikke -metaller. Alle de som hadde lignende kjemiske egenskaper og affinitet.
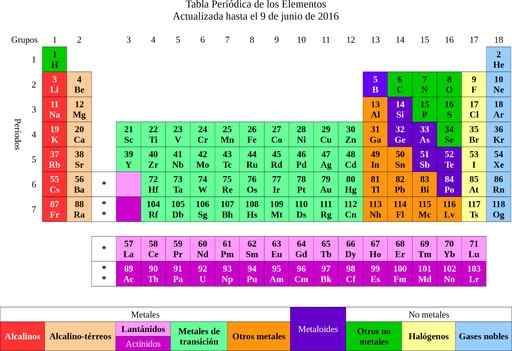 Figur 2. Periodisk elementer. Kilde: Wikimedia Commons.
Figur 2. Periodisk elementer. Kilde: Wikimedia Commons. Fra elementene gikk det til ideen om atomer, et ord som betyr udelelig. Kort tid senere la forskerne merke til at atomene hadde en struktur. I tillegg hadde atomene to typer elektrisk ladning (positiv og negativ).
Subatomiske partikler
I Rutherfords eksperimenter der han bombet atomene til en tynn gullplate med alfapartikler, ble strukturen til atomet avslørt: en liten positiv kjerne omgitt av elektroner.
De fortsatte å bombardere atomene til flere og flere energipartikler og fremdeles gjøres, for å avdekke hemmelighetene og egenskapene til den mikroskopiske verden i økende grad i mindre skala.
På denne måten ble standardmodellen nådd, som slår fast at de sanne elementære partiklene er de som atomene er sammensatt. På sin side gir atomer opphav til elementene, disse til forbindelsene og alle kjente interaksjoner (unntatt gravitasjon). Totalt er det 12 partikler.
Disse grunnleggende partiklene har også sin periodiske bord. Det er to grupper: de fermioniske partiklene av spinn ½ og bosonisk. Bosonic er ansvarlig for interaksjoner. Fermionics er 12 og er de som gir opphav til protoner, nøytroner og atomer.
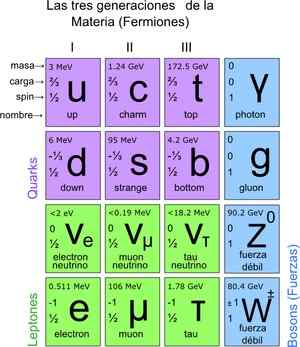 Figur 3. Grunnleggende partikler. Kilde: Wikimedia Commons.
Figur 3. Grunnleggende partikler. Kilde: Wikimedia Commons. Hvordan telle partikler i mikroskopisk skala?
Over tid oppdaget kjemikerne de relative massene av elementene fra presise målinger i kjemiske reaksjoner. For eksempel kan det bestemmes at karbon er 12 ganger tyngre enn hydrogen.
Det ble også bestemt at hydrogen er det letteste elementet, slik at dette elementet ble tildelt den relative massen 1.
På den annen side er kjemikalier som kreves for å kjenne antall partikler som er involvert i en reaksjon, slik at verken noe reagens mangler. For eksempel krever et vannmolekyl to hydrogenatomer og ett oksygen.
Kan tjene deg: bølgende fenomenerFra denne bakgrunnen blir begrepet mol født. En mol av ethvert stoff er en fast mengde partikler som tilsvarer molekyl- eller atommassen i gram. Dermed ble det bestemt at 12 gram karbon har samme antall partikler som 1 gram hydrogen. Dette tallet er kjent som Avogadro -nummeret: 6.02 x 10^23 partikler.
-Eksempel 1
Beregn hvor mange gullatomer som er i 1 gram gull.
Løsning
Det er kjent at gull har en atomvekt på 197. Disse dataene finner du i den periodiske tabellen og indikerer at et gullatom er 197 ganger tyngre enn et av hydrogen og 197/12 = 16.416 ganger tyngre enn karbon.
En gullmol har 6,02 × 10^23 atomer og har atomvekten uttrykt i gram, det vil si 197 gram.
I et gram gull er det 1/197 mol gull, det vil si 6,02 × 10^23átomos/197 = 3,06 x10^23 gullatomer.
-Eksempel 2
Bestem antall kalsiumkarbonatmolekyler (Caco3) at det er i 150 gram av dette stoffet. Si også hvor mange kalsiumatomer, hvor mange karbon og hvor mange oksygen det er i denne forbindelsen.
Løsning
Den første tingen er å bestemme molekylmassen til kalsiumkarbonat. Den periodiske tabellen indikerer at kalsium har en molekylvekt på 40 g/mol, karbon 12 g/mol og oksygen 16 g/mol.
Så molekylmassen til (Caco3) være:
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Hver 100 gram kalsiumkarbonat er 1 mol. Deretter tilsvarer i 150 gram 1,5 føflekker.
Hver mol karbonat har 6,02 x 10^23 karbonatmolekyler, så i 1,5 mol karbonat er det 9,03 x 10^23 molekyler.
Oppsummering, i 150 gram kalsiumkarbonat er det:
- 9.03 x 10^23 Kalsiumkarbonatmolekyler.
- Kalsiumatomer: 9.03 x 10^23 .
- Også 9.03 x 10^23 karbonatomer
- Til slutt, 3 x 9,03 x 10^23 oksygenatomer = 27,09 x 10^23 oksygenatomer.
Referanser
- Anvendt biologi. Hva er de mikroskopiske tiltakene?. Gjenopprettet fra: YouTube.com
- Kjemisk utdanning. Makroskopiske, submikroskopiske og symbolske fremstillinger om materie. Gjenopprettet fra: Scielo.org.MX.
- Garcia a. Interaktiv fysikkurs. Makro -State, Microstates. Temperatur, entropi. Hentet fra: SC.Ehu.er
- Den mikroskopiske strukturen i materien. Gjenopprettet fra: Alipso.com
- Wikipedia. Mikroskopisk nivå. Gjenopprettet fra: Wikipedia.com

