Tertiær struktur for hovedegenskapene

- 3029
- 82
- Oliver Christiansen
De Tertiær struktur av proteiner Det er den tre -dimensjonale konformasjonen som polypeptidkjeder skaffer seg når de brettes på seg selv. Denne konformasjonen vises ved interaksjoner mellom sidekjedene til aminosyreavfallet til polypeptidet. Sidekjeder kan samhandle uavhengig av sin posisjon i proteinet.
Fordi det avhenger av interaksjonen mellom R -grupper, viser den tertiære strukturen ikke -aktive aspekter av kjeden, da disse gruppene er forskjellige for hver aminosyrerest. Sekundærstruktur avhenger derimot av karboksyl- og aminogrupper, som er til stede i alle aminosyrer.
 Tertiær struktur av kinase fosfataseprotein, med sekundære strukturer i alfa og beta -blad. Tatt og redigert fra: A2-33. Modifisert av Alejandro Porto. [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Tertiær struktur av kinase fosfataseprotein, med sekundære strukturer i alfa og beta -blad. Tatt og redigert fra: A2-33. Modifisert av Alejandro Porto. [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Noen forfattere antyder at fibrøse proteiner har en enkel tertiær struktur, men likevel påpeker andre forfattere at denne strukturen er typisk for kuleproteiner.
[TOC]
Fibrøse proteiner
I fibrøse proteiner er polypeptidkjeder anordnet i form av lange filamenter eller lange ark; De består generelt av en unik type sekundærstruktur. Denne sekundære strukturen er i de fleste tilfeller viktigere enn tertiærstrukturen for å bestemme proteinform.
Den biologiske funksjonen er strukturell, og gir styrke og/eller elastisitet til organene og strukturene der de blir funnet, mens de holder dem sammen. Alle fibrøse proteiner er uoppløselige i vann, på grunn av den store mengden hydrofobe aminosyrer de presenterer.
Blant disse fibrøse proteinene er keratiner og kollagen. Førstnevnte finnes i konjunktive stoffer og i strukturer som hår, negler (α-queratinas), skalaer og fjær (ß-cheatiner). Kollagen finnes i mellomtiden i bein, sener og hud, blant andre.
α-queratinas
Disse proteinene er en del av de såkalte mellomfilamenter proteiner, som spiller en viktig rolle i cytoskjelettet til flercellede organismer. I tillegg er de den viktigste bestanddelen av hår, negler, ull, horn, høver og et av de viktigste dyret hudproteiner.
Kan tjene deg: Kinyoun fargingStrukturen til molekylet er en α -propell. To tråder av α-queratin kan ordnes parallelt og melde seg på hverandre med sine R-hydrofobe grupper som samhandler mellom dem. På denne måten skapes en superhelisk eller ballstruktur med vikling til venstre.
Den tertiære strukturen til α keratin er enkel og er dominert av sekundærstrukturen til α-helix. På den annen side er den kvartære strukturen også til stede, siden to molekyler deltar i den superhelikoidale strukturen, som samhandler gjennom ikke -kovalente bindinger.
β-queratinas
Den primære strukturen ligner på α-queratinas, men den sekundære strukturen er dominert av β-ark. De er den viktigste bestanddelen av skalaene til krypdyrene og fuglene til fuglene.
Kollagen
Dette proteinet kan representere mer enn 30% av den totale proteinmassen til noen dyr. Det finnes i brusk, bein, sener, hornhinne og hud, blant annet vev.
Den sekundære strukturen til kollagenet er unik, og blir representert av en Levogira -propell med 3,3 aminosyreavfall for hver fang. Tre levogyous propellkjeder (α).
Tropocollagen -molekyler kommer sammen for å danne en kollagenfiber som har stor motstand, høyere enn stål og sammenlignbar med høy motstandskobber.
Andre fibrøse proteiner
Andre typer fibrøse proteiner er fibroin og elastin. Den første av dem er dannet av β -ark, hovedsakelig konstituert av Glycina, Alanine og Serine.
Sidekjedene til disse aminosyrene er små, slik at de kan pakkes tett. Resultatet er en fiber som både er veldig motstandsdyktig og veldig upuffers.
Kan tjene deg: Fosfatbuffer (PBS): Foundation, Preparation and UsesI elastinen erstatter valinen serinen blant dens viktigste bestanddeler aminosyrer. I motsetning til fibroine, er elastin veldig utvidbar, derav navnet. I molekylets konstitusjon virker lysin også, som kan delta i kryss -kobling som lar elastin gjenopprette sin form når spenningen opphører.
Kuleproteiner
Globulære proteiner, i motsetning til fibrøse, er oppløselige og har generelt flere typer sekundære strukturer. Imidlertid er disse viktigere tre -dimensjonale konformasjoner som de skaffer seg når de brettes på seg selv (tertiær struktur).
Disse spesielle tre -dimensjonale konformasjonene gir spesifikk biologisk aktivitet til hvert protein. Hovedfunksjonen til disse proteiner er regulatorisk, som med enzymer.
Kjennetegn på den tertiære strukturen til kuleproteiner
Den tertiære strukturen til kuleproteiner har noen viktige egenskaper:
- Globulære proteiner er kompakte takket være emballasje når polypeptidkjeden bretter.
- Det fjerne aminosyreavfallet i den primære strukturen til polypeptidkjeder er nært, og kunne samhandle med hverandre på grunn av foldingen.
- Større kuleproteiner (mer enn 200 aminosyrer) kan ha flere kompakte segmenter, uavhengige mellom dem og med spesielle funksjoner, og hvert av disse segmentene kalles domene. Et domene kan ha mellom 50 og 350 aminosyreavfall.
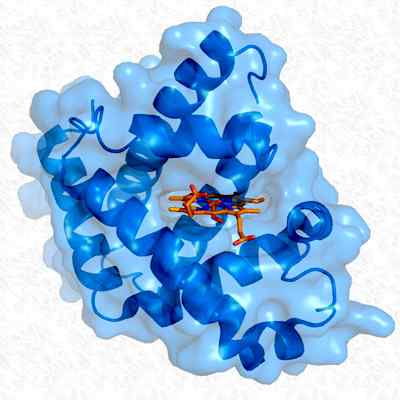 Tertiær struktur av myoglobin. Tatt og redigert fra: Thomas Splettstoesser. Modifisert av Alejandro Porto. [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Tertiær struktur av myoglobin. Tatt og redigert fra: Thomas Splettstoesser. Modifisert av Alejandro Porto. [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Generelle regler for folding av globale proteiner
Som allerede nevnt har proteiner spesielle sammenleggbare former, som gir dem også spesielle egenskaper. Denne foldingen er ikke tilfeldig og favoriseres både av den primære og sekundære strukturen og av noen ikke -kovalente interaksjoner, og det er også noen fysiske begrensninger for foldingen, så noen regler er blitt formulert:
Kan tjene deg: primære lymfoide organer- Alle kuleproteiner har definert distribusjonsmønstre, med hydrofobe grupper rettet inn i molekylet og hydrofilt avfall i det ytre laget i det ytre laget. For dette er det nødvendig med minst to lag med sekundærstruktur. Β-a-ß-sløyfen og α-a-toppunktet kan bidra med de to lagene.
- Β -arkene er vanligvis ordnet i en Levogira -rullet form.
- I en polypeptidkjede kan forskjellige svinger oppstå for å bevege seg fra en sekundær til en annen struktur, for eksempel β eller y -svinger, som kan kunne investere retningen til kjeden i fire aminosyreavfall eller mindre.
- Globulære proteiner har α, β -ark, uregelmessig strukturerte vendinger og segmenter.
Protein denaturering
Hvis et protein mister sin opprinnelige (naturlige) tre -dimensjonale struktur, mister det sin biologiske aktivitet og de fleste av sine spesifikke egenskaper. Denne prosessen er kjent som denaturering.
Denaturering kan oppstå når naturlige miljøforhold endres, for eksempel ved varierende temperatur eller pH. Prosessen er irreversibel i mange proteiner; Andre kan imidlertid spontant gjenopprette sin naturlige struktur ved å gjenopprette normale miljøforhold.
Referanser
- C.K. Mathews, k.OG. Van Hold & K.G. Ahern (2002). Biochemery. 3. utgave. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & V.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biochemery. 5. utgave. W. H. Freeman og selskap.
- W.M. Becker, l.J. Kleinsmith & J. Hardin (2006) verden av cellen. 6. utgave. Pearson Education Inc.
- TIL.Lehninger (1978). Biokjemi. Omega Editions, S.TIL.
- T. McKee & J.R. McKee (2003). Biokjemi: det molekylære livets grunnlag. 3. utgave. McGraw-HIII Companies, Inc.
- « Fermioniske kondensategenskaper, applikasjoner og eksempler
- Dodecil natriumsulfat (SDS) struktur, egenskaper, bruk »

