Etano
- 1131
- 340
- Dr. Andreas Hopland
 Estano -struktur
Estano -struktur Hva er etan?
Han Etano Det er en enkel formel C hydrokarbon2H6 Med en fargeløs og toalettgass natur som har svært verdifull og diversifisert bruk i etylensyntese. I tillegg er det en av landgassene som også har blitt oppdaget i andre planeter og stjernemål rundt solsystemet. Det ble oppdaget av forsker Michael Faraday i 1834.
Blant det store antallet organiske forbindelser dannet av karbon- og hydrogenatomer (kjent som hydrokarboner), er det de som er i en gassformig tilstand ved temperaturer og miljøtrykk, som brukes sterkt i en rekke bransjer.
Disse kommer vanligvis fra den gassformige blandingen som kalles "naturgass", et produkt av høy verdi for menneskeheten, og utgjør blant andre metan, etan, propan og butantyper; Kvalifiserer i henhold til mengden karbonatomer i kjeden.
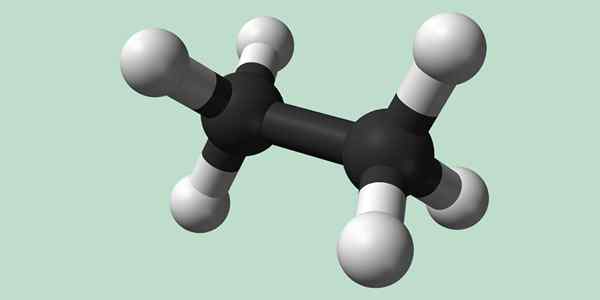
Kjemisk struktur av etan
Estano er et formel C -molekyl2H6, vanligvis sett på som en forening av to metylgrupper (-CH3) For å danne hydrokarbonet til en enkel karbon-karbonbinding. Det er også den enkleste organiske forbindelsen etter metan, som representerer seg selv:
H3C-CH3
Karbonatomer i dette molekylet har hybridisering av SP -typen3, Så molekylære bindinger har fri rotasjon.
Det er også et iboende fenomen av Etano, som er basert på rotasjonen av dens molekylstruktur og minimumsenergien som kreves for å produsere en 360 -graders koblingsrotasjon, som forskere har kalt "Etano Barrera".
Av denne grunn, Ethan.
 Kjemisk struktur av etan. Kilde: Wikimedia Commons
Kjemisk struktur av etan. Kilde: Wikimedia Commons Syntese av etan
Estano kan lett syntetiseres fra Kolbe -elektrolyse, en organisk reaksjon der to trinn oppstår: en elektrokjemisk dekarboksylering (fjerning av karboksylgruppen og frigjøring av karbondioksid) av to karboksylsyrer, og kombinasjonen av produktene mellomprodukter for å danne en kovalent binding.
Tilsvarende resulterer eddiksyreelektrolyse i dannelse av etan og karbondioksid, og denne reaksjonen brukes til å syntetisere den første.
Oksidasjonen av eddiksyreanhydrid ved virkning av peroksider, et konsept som ligner på elektrolysen av Kolbe, resulterer også i dannelsen av etan.
Kan tjene deg: bidrag fra kjemi til menneskehetenPå samme måte kan det skilles effektivt fra naturgass og metan ved en flytende prosess ved å bruke kryogene systemer for å fange denne gassen og skille den fra blandinger med andre gasser.
Turbo -ekspansjonsprosessen er favoritten for denne rollen: gassblandingen er laget av en turbin, og genererer en utvidelse av den, til temperaturen faller under -100 ° C.
Allerede på dette tidspunktet kan komponentene i blandingen differensieres, så den flytende etan fra gassformig metan og de andre artene som er involvert i bruken av en destillasjon vil bli separert.
Estano -egenskaper
Estano presenteres i naturen som et toalett og fargeløs gass til standardtrykk og temperaturer (1 atm og 25 ° C). Den har et kokepunkt på -88,5 ° C, og et fusjonspunkt på -182,8 ° C. I tillegg påvirkes det ikke av eksponering for sterke syrer eller baser.
Løselighet av etan
Etano molekyler er symmetrisk konfigurasjon og har svake attraksjonskrefter som holder dem sammen, kalt spredningskrefter.
Når etan prøver å løse seg opp i vann, er tiltrekningskreftene dannet mellom gass og væske veldig svake, slik at etanen neppe vil bli med vannmolekylene.
Av denne grunn er løseligheten av etan betydelig lav, og øker litt når systemtrykket stiger.
Krystallisering av etan
Estano kan størkes, noe som gjør ustabile etankrystaller med kubikk krystallinsk struktur.
Med en temperaturnedgang utover -183,2 ° C blir denne strukturen monoklinisk, noe som øker stabiliteten til molekylet.
Forbrenning av etan
Dette hydrokarbonet, selv når det ikke er mye brukt som drivstoff, kan brukes i forbrenningsprosesser for å generere karbondioksid, vann og varme, som er representert som følger:
2 c2H6 + 72 → 4CO2 + 6H2O + 3120 KJ
Det er også muligheten for å brenne dette molekylet uten overflødig oksygen, som er kjent som "ufullstendig forbrenning", og som resulterer i dannelse av amorft karbon- og karbonmonoksid i en uønsket reaksjon, i henhold til mengden oksygen påført:
Kan tjene deg: steroler: struktur, funksjoner og eksempler2 c2H6 + 32 → 4C + 6H2Eller + varme
2 c2H6 + 4. plass2 → 2C + 2CO + 6H2Eller + varme
2 c2H6 + 5. plass2 → 4CO + 6H2Eller + varme
I dette området skjer forbrenning ved en serie med frie radikale reaksjoner, som er nummerert i hundrevis av forskjellige reaksjoner. For eksempel i ufullstendige forbrenningsreaksjoner kan forbindelser som formaldehyd, acetaldehyd, metan, metanol og etanol dannes.
Dette vil avhenge av forholdene der reaksjonen og reaksjonene til involverte frie radikaler forekommer. Etylen kan også dannes ved høye temperaturer (600-900 ° C), som er et svært ønsket produkt etter industri.
Estano i atmosfæren og i himmellegemer
Estano er til stede i atmosfæren på planeten i spor, og det mistenkes at mennesket har klart å doble denne konsentrasjonen siden han begynte å utøve industrielle aktiviteter.
Forskere mener at en stor del av den nåværende tilstedeværelsen av ETA i atmosfæren skyldes forbrenningen av fossilt brensel, selv om verdensutslippet av etan har gått ned nesten halvveis siden Lutita -gassproduksjonsteknologiene ble forbedret (en naturgassskilde).
Denne arten forekommer også naturlig ved effekten av solstråler på atmosfærisk metan, som rekombiner og danner et etanmolekyl.
Det er en etan i flytende tilstand på overflaten av Titan, en av Saturns måner. Dette presenteres i større mengde på Vid Flumina River, som renner i mer enn 400 kilometer til et av havene. Denne forbindelsen har også blitt bevist på kometer, og på overflaten av Pluto.
Bruk av etan
Etylenproduksjon
Bruken av etan er hovedsakelig basert på etylenproduksjon, det organiske produktet med større bruk i verdensproduksjon, gjennom en prosess kjent som Steam Stage.
Denne prosessen består i å passere en utvannet ethan.
Reaksjonen skjer ved en ekstremt høy temperatur (mellom 850 og 900 ° C), men oppholdstiden (tiden som etanen passerer innenfor ovnen) må være kort slik at reaksjonen er effektiv. Ved høyere temperaturer genereres mer etylen.
Kan tjene deg: neon: historie, egenskaper, struktur, risiko, brukGrunnleggende kjemisk dannelse
Etano har også blitt studert som hovedkomponent i dannelsen av grunnleggende kjemikalier. Oksidativ klorering er en av prosessene som er hevet for å oppnå vinylklorid (en PVC -komponent), og erstatte andre mindre økonomiske og mer kompliserte.
Kjølemedium
Til slutt brukes etan som kjølemedium i vanlige kryogene systemer, og viser også kapasiteter til å fryse små prøver i laboratoriet for analyse.
Det er en veldig god erstatning for vann, som tar mer å avkjøle de delikate prøvene, og kan også generere dannelsen av skadelige iskrystaller.
Risiko for etan
-Estano har evnen til å bli betent, hovedsakelig når den blir med i luften. En prosentandel på 3,0 til 12,5% volum etan i luften, kan en eksplosiv blanding dannes.
-Det kan begrense oksygen i luften det er funnet, og av denne grunn presenterer det en risikofaktor for kvelning for mennesker og dyr som er til stede og utsatt.
-Etanen i frossen flytende form kan alvorlig brenne huden hvis den kommer i direkte kontakt med den, og også fungere som et kryogent medium for ethvert objekt som berører, og fryser den i øyeblikk.
-Dampene til flytende etan er tyngre enn luft og konsentrerer seg på bakken, dette kan utgjøre en risiko for tenning som kan generere en kjedeforbrenningsreaksjon.
-Inntak av etano kan forårsake kvalme, oppkast og indre blødninger. Innånding, i tillegg til kvelning, forårsaker hodepine, forvirring og humorendring. Død på grunn av hjertestans er mulig på høye utstillinger.
-Det representerer en klimagass som sammen med metan og karbondioksid bidrar til global oppvarming og klimaendringer generert av menneskelig forurensning. Heldigvis er det mindre rik og varig enn metan, og absorberer mindre stråling enn dette.
Referanser
- Britannica, e. (s.F.). Etan. Hentet fra Britannica.com
- NES, g. V. (s.F.). Enkrystallstrukturer og elektrontetthetsfordelinger av etan, ethylen og acetylen. Teppe kom seg.Nl
- Nettsteder, g. (s.F.). Ethan: Kilder og vasker. Hentet fra nettsteder.Google.com
- Softschools (s.F.). Etanformel. Gjenopprettet fra softschools.com
- Wikipedia (s.F.). Etan. Hentet fra IN.Wikipedia.org

