Europio struktur, egenskaper, få, bruker

- 1397
- 135
- Markus Fredriksen
Han Europio Det er et kjemisk element som tilhører de sjeldne jordene, representert av EUs kjemiske symbol, og hvis navn skyldes, tydeligvis, til det europeiske kontinentet. Dette er det mest reaktive av sjeldne jordmetaller, og sammenligner litium, kalsium og barium, og det er grunnen til at dens mineralogiske diffusjon er veldig spredt.
Det er en av de mest sjeldne og dyre metaller, på grunn av alle prosedyrene som må gjøres for å hente ut urenheter. Fysisk viser det en gråaktig gylden glød, forårsaket av den raske oksidasjonen, den er knapt utsatt for luften. Derfor er det sjelden mulig å lagre den med sin autentiske sølvfarge.
 Oksidert europium. Kilde: Hi-res Images ofchemical Elements/CC av (https: // creativecommons.Org/lisenser/av/3.0)
Oksidert europium. Kilde: Hi-res Images ofchemical Elements/CC av (https: // creativecommons.Org/lisenser/av/3.0) Europium er så reaktivt at det må lagres i ampulser eller forseglede beholdere under inerte argonatmosfærer. Selv nedsenket i mineralolje oksideres av det lille oppløste oksygenet.
Et enestående trekk ved europium er luminescensen, spesielt observert i forbindelsene med oksidasjonsnummer +3, for eksempel USA2ENTEN3, som er et rødt fosfor som brukes i uendelig med elektroniske enheter, og også på euro -billetter for å forhindre forfalskninger.
[TOC]
Europio Discovery
Oppdagelsen av europium ble opprettet i deler, gjennom det nittende århundre, og i forskjellige land (Sverige, Tyskland og Sveits) på det europeiske kontinentet. Europiumioner var vanskelige å identifisere fordi deres absorpsjonsspektre blandet med andre sjeldne jordmetaller, for eksempel bakke, gadolinium og Lanthean, samt samarium.
Derfor dro identifiseringen og isolasjonen av alle disse metallene Europium som en urenhet uten å karakterisere. For eksempel hadde isolasjonen av et rent utvalg av Cerio, i 1839 av Carl Gustav Mosander, som et produkt anerkjennelse av andre nye elementer: Lantano og Didimio.
Mens han studerte Didimio og konklusjonen ble nådd at den virkelig besto av en blanding av andre elementer (Proseodymium and Neodymium), dukket Samario opp, funnet i 1879 av Paul èmile Lecoq.
Kan tjene deg: aluminiumhydrid (ALH3): struktur, egenskaper, brukSenere, i 1886, renset den sveitsiske kjemikeren Jean Charles Galissard Samarium -prøver å finne Gadolinio. Lecoq for 1892 hadde allerede studert spektrene til Gadolinio og det til et annet nytt element.
Femten år senere, i 1901, isolerte den franske kjemikeren Eugène Anatole DeMarcay endelig dette nye elementet og døpte det som Europium, til ære for Europa.
Europiums kjemisk struktur
Europiumatomer forblir forent takket være den metalliske bindingen, og deltar i det elektronene i deres 4F og 6s orbitaler. Som et resultat av dens elektroniske egenskaper, atomradioer og modus for emballasjen, ender europium opp med å ta i bruk en kubikk krystallinsk struktur sentrert på kroppen (BCC), og er en av de minst tette.
Det er ingen bibliografiske kilder som nevner en annen polymorf for Europio, bortsett fra nevnte BCC -fase, innenfor andre temperaturområder; Men under forskjellige press.
For eksempel vedtar europium som ble sendt til et trykk nær 18 GPA en kompakt sekskantet struktur, og transformerer seg deretter til en monoklinisk fase til høyere trykk av 31.5 GPA.
Elektronisk konfigurasjon
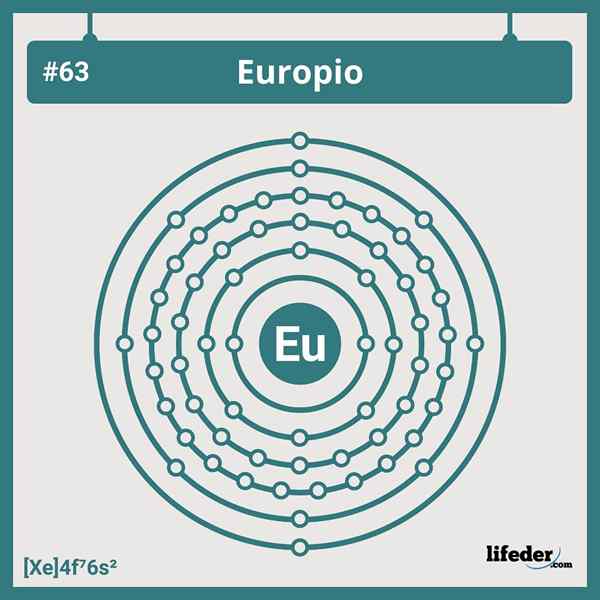 Elektronisk europiumkonfigurasjon
Elektronisk europiumkonfigurasjon Den forkortede elektroniske konfigurasjonen av Europium er:
[Xe] 6s24f7
Å være i posisjon eller gruppe 7 i Lantanide -serien, og har syv elektroner som okkuperer sine 4F -orbitaler; Og derfor tilsvarer det ikke noen av avvikene vi finner i de elektroniske konfigurasjonene for elementene i den periodiske tabellen.
Europio egenskaper
Fysisk utseende
Sølvhvit metall, myk hardhet som ligner på bly, og som blir gylden når den blir utsatt for luften, som dekker et lag med oksid og karbonat.
Atomnummer
63
Molmasse
151.96 g/mol
Smeltepunkt
826 ºC
Kokepunkt
1529 ºC
Tetthet
Solid: 5.264 g/cm3
På smeltepunktet: 5.13 g/cm3
Oksidasjonsstater
Hovedoksidasjonstilstandene i europium er +2 (EU2+) og +3 (EU3+), Å være +1 (EU+) Den minst vanlige av de tre.
Kan tjene deg: Polar kovalent lenke: Kjennetegn og eksemplerIoniseringsenergier
-Først: 547.1 kJ/mol (EU+ gassform)
-For det andre: 1085 kJ/mol (EU2+ gassform)
-Tredje: 2404 kJ/mol (EU3+ gassform)
Elektronegativitet
1.2 på Pauling -skalaen.
Magnetisk ordre
Paramagnetisk
Reaktivitet
Europiumens reaktivitet er sammenlignbar med litium, og det er derfor det mest reaktive metallet av sjeldne jordarter. Reagerer for eksempel raskt med vann for å danne det tilsvarende hydroksid, EU (OH)3, Gul, som i motsetning til alkaliske hydroksider er uoppløselig i vann:
2 EU + 6 H2O → 2 EU (OH)3 + 3 H2
Også når det brenner i en lettere oksidert til USA2ENTEN3 Og avskjediget en rødlig flamme, som minner om litium:
4 EU + 3 O2 → 2 EU2ENTEN3
Europium er i stand til å danne mange forbindelser med oksidasjonstilstanden på +2, fordi det har sine orbitaler F halvfull (4f7), som gir atomet en uvanlig elektronisk stabilitet.
EU -kationen2+ presenterer en kjemisk oppførsel som ligner på BA2+, Men i motsetning til sistnevnte fungerer det som et moderat sterkt reduksjonsmiddel, og oksiderer USA3+.
Å skaffe
Råmateriale
Europium er til stede i sjeldne jordmineraler som Bastnasita og monazitten. Fordi det holder en vis. Det er grunnen til at du skaffer deg er veldig dyr.
Prosesser
EU -ionene3+ De er en del av mange rust og sjeldne jordfosfater. Derfor er det første trinnet å skille dem fra de andre metaller til stede. For å gjøre dette behandles mineraler, spesielt bastnasitten; De blir berørt, oppløses i sterke syrer eller baser, og fraksjonerte nedbør blir utsatt ved å bruke forskjellige reagenser. På samme måte brukes ionebytterkromatografi for å skille USA3+.
Når mineralet behandles, oppnås et konsentrat av EU -ioner3+, som kan reduseres ved bruk av metallisk sink eller et amalgam av det, slik at de reduseres til USA2+. Så USA2+ Coprecipita på karbonat eller bariumsulfat.
Kan tjene deg: katalytisk hydrogeneringDette bunnfallet holdes og gjennomgår en separasjon for å oppnå EU -oksid2ENTEN3, som reduseres med Lantano i en smeltedigel av Tantalio, for endelig å destilere og kondensere det metalliske europium.
En annen metode for å oppnå europium er å utføre en elektrolyse av en blanding av EUCL3 og NaCl eller CACL2 smeltet. Dermed oppstår klorgass ved anoden, mens den metalliske europio dannes i katoden.
Bruk/applikasjoner
 Den rødlige luminescence sett i denne eurobilletten, under en UV -lampe, skyldes en europiumforbindelse. Kilde: repro av h. Grobe/CC av (https: // creativecommons.Org/lisenser/av/3.0)
Den rødlige luminescence sett i denne eurobilletten, under en UV -lampe, skyldes en europiumforbindelse. Kilde: repro av h. Grobe/CC av (https: // creativecommons.Org/lisenser/av/3.0) Europium i sin metalliske form mangler rutinemessige bruksområder. Forbindelsene er imidlertid en annen historie, spesielt EU -oksid2ENTEN3, hvis fosforescens er laget av en uunnværlig komponent av skjermene på enheter, skjermer og TV -er. Dette er fordi det er et rødt fosfor, og avgir et karakteristisk rødt lys.
Europio (III) er også brukt for å forhindre at Euros -billettene blir forfalsket med UV -lys for å bekrefte den.
På den annen side, når det er blandet med Euro (II) forbindelser, som er blålige kamper, oppnås et hvitt lys, veldig tilbakevendende i glasset av lysstofflamper.
Europium tilsettes i små mengder til strontiumaluminat for å fremstille fosfor i forskjellige farger, som skiller seg ut for å ha en langvarig fosforesens.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Nasjonalt senter for bioteknologiinformasjon. (2020). Europium. PUBCHEM Element Sammendrag. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2020). Europium. Hentet fra: i.Wikipedia.org
- Redaktørene av Enyclopaedia Britannica. (2020). Europium. Gjenopprettet fra: Britannica.com
- R. J. Ektemann et al. (27. august 2012). Europium-IV: en ukjent. Gjenopprettet fra: Tidsskrifter.APS.org
- David. Skowron. (26. november 2017). Hva er europium brukt til? - Vanlig og historisk bruk. Studere. Gjenopprettet fra: Studie.com
- Dr. Doug Stewart. (2020). Europium element fakta. Gjenopprettet fra: Chemicool.com
- « Monoteism opprinnelse, egenskaper og religioner
- Kulturelle forskjeller konsept og eksempler mellom land »

