Rutherford eksperimenthistorie, beskrivelse og konklusjoner
- 4086
- 1047
- Marius Aasen
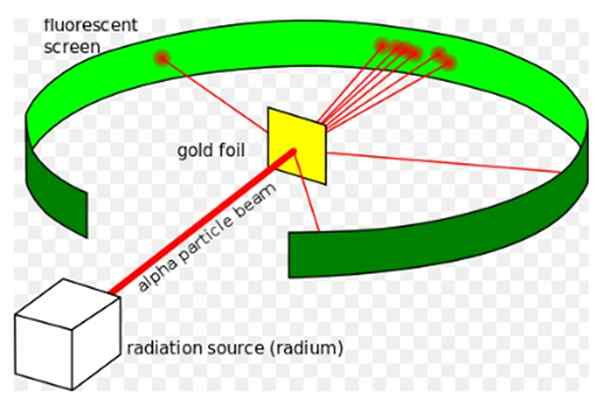
Han Rutherford -eksperiment, utført mellom 1908 og 1913, besto det av å bombardere et tynt gullark på 0.0004 mm tykke, med alfapartikler og analyser spredningsmønsteret som disse partiklene etterlot på en lysstoffrør.
Egentlig gjennomførte Rutherford mange eksperimenter, og foredlet detaljene mer og mer. Etter å ha analysert resultatene nøye, ble to veldig viktige konklusjoner avslørt:
-Den positive belastningen på atomet er konsentrert i en region som kalles kjerne.
-Denne atomkjernen er utrolig liten sammenlignet med atomets størrelse.
 Figur 1. Rutherfords eksperiment. Kilde: Wikimedia Commons. Kurzon [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Figur 1. Rutherfords eksperiment. Kilde: Wikimedia Commons. Kurzon [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Ernest Rutherford (1871-1937) var en fysiker født i New Zealand, hvis interessefelt var radioaktivitet og natur av materie. Radioaktivitet var et nylig fenomen da Rutherford begynte sine eksperimenter, det hadde blitt oppdaget av Henri Becquerel i 1896.
I 1907 flyttet Rutherford til University of Manchester i England for å studere strukturen til atomet ved å bruke disse alfapartiklene som sonder for å granske interiøret i en så liten struktur. Fysikerne Hans Geiger og Ernest Marsden fulgte ham i oppgaven.
De huset håpet om å se hvordan en alfapartikkel, som er et dobbelt ionisert heliumatom, samhandlet med et unikt gullatom, for å sikre at ethvert avvik som det opplevde bare skyldtes den elektriske kraften.
Imidlertid krysset de fleste av alfapartiklene gullarket som lider bare et lite avvik.
Dette faktum var i total enighet med Thomsons atommodell, men til forskernes overraskelse opplevde en liten prosentandel av alfapartikler et ganske bemerkelsesverdig avvik.

Og en enda mindre prosentandel av partikler kom tilbake, og spretter helt bakover. Hvorfor var disse uventede resultatene?
[TOC]
Beskrivelse og konklusjoner av eksperimentet
Faktisk er alfa -partiklene som Rutherford brukte som sonde, heliumkjerner, og på den tiden var det bare kjent at disse partiklene hadde positiv ladning. I dag er det kjent at alfapartikler er sammensatt av to protoner og to nøytroner.
Alfa og beta -partikler hadde blitt identifisert av Rutherford som to forskjellige slags stråling fra uran. Alfa -partikler, mye mer massiv enn elektronet, har positiv elektrisk ladning, mens beta -partikler kan være elektroner eller positroner.
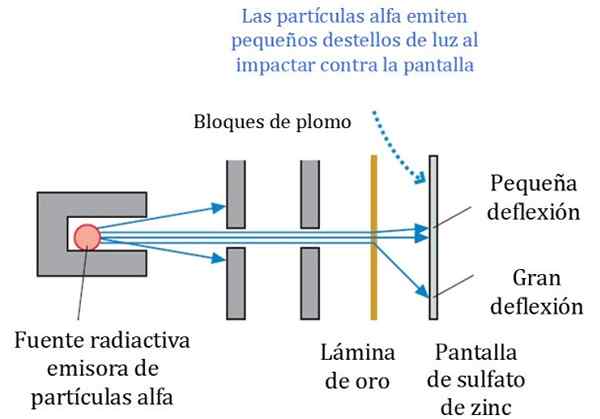 Figur 2. Detaljert opplegg for Rutherford, Geiger og Marsden eksperiment. Kilde: r. Ridder. Fysikk for forskere og ingeniørfag: En strategitilnærming. Pearson.
Figur 2. Detaljert opplegg for Rutherford, Geiger og Marsden eksperiment. Kilde: r. Ridder. Fysikk for forskere og ingeniørfag: En strategitilnærming. Pearson. Figur 2 viser et forenklet skjema for eksperimentet. Alfa -partikkelstrålen kommer fra en radioaktiv kilde. Geiger og Marsden brukte radongass som emitter.
Blyblokker ble brukt for å rette strålingen til gullarket og forhindre dem i å stoppe direkte til lysstoffskjermen. Bly er et materiale som absorberer stråling.
Kan tjene deg: sentrioler: funksjoner og egenskaperDeretter ble den rettede bjelken således påvirket på et tynt gullark, og de fleste av partiklene følger veien til den lysstoffrørskjermbildet, der de etterlot et lite lett fotavtrykk. Geiger hadde ansvaret for å telle dem en etter en, selv om de da designet en enhet som gjorde det.
At noen partikler opplevde en liten avbøyning, overrasket ikke Rutherford, Geiger og Marsden. Tross alt, i atomet er det positive og negative ladninger som utøver styrke på alfapartikler, men siden atomet er nøytralt, som de allerede visste, skal avvikene være små.
Eksperimentet overraskelse er at noen få positive partikler ble sprettet nesten direkte.
Konklusjoner
Rundt 1 av 8000 alfapartikler opplevde avbøyning i vinkler større enn 90º. Få, men nok til å stille spørsmål ved noen ting.
Atommodellen i Boga var den av Thomsons Pudin, tidligere Rutherford -professor ved Cavendish Laboratory, men han lurte på om ideen om et atom uten en kjerne og med elektronene innebygd som rosiner, det var riktig.
Fordi det viser seg at disse store avbøyningen av alfapartiklene og det faktum at noen få er i stand til å komme tilbake, kan det bare forklares hvis et atom har en liten, tung og positiv kjerne. Rutherford antok at bare styrkene til elektrisk attraksjon og frastøtning, som indikert av Coulombs lov, var ansvarlig for ethvert avvik.
Når noen av alfapartiklene nærmer seg kjernen direkte, og siden den elektriske kraften varierer med omvendt kvadrat på avstanden, føler de en frastøtning som forårsaker dem spredning av stor vinkel eller avviket bakover.
For å sikre opplevde Geiger og Marsden bombeark av forskjellige metaller, ikke bare gull, selv om dette metallet var det mest passende for deres formbarhet, for å lage veldig fine ark.
Når han oppnår lignende resultater, overbeviste Rutherford om at den positive belastningen i atomet skal være lokalisert i kjernen, og ikke spredt i hele volumet, som Thomson postulert i modellen sin.
På den annen side, som de aller fleste alfapartikler, skjedde det uten å avvike, kjernen skal være veldig, veldig liten sammenlignet med atomstørrelsen. Imidlertid måtte denne kjernen konsentrere seg mesteparten av atomets masse.
Påvirkninger i atommodellen
Resultatene var veldig overrasket over Rutherford, som erklærte på en konferanse i Cambridge: “… Det er som når du skyter en 15 -tommers kanonkule mot et ark med silkepapir og prosjektilet spretter direkte til deg og treffer deg"".
Kan tjene deg: 10 funksjoner av det teoretiske rammeverket for en undersøkelseSiden disse resultatene ikke kunne forklares med Thomsons atommodell, foreslo Rutherford at atomet ble konstituert av en kjerne, veldig liten, veldig massiv og positivt lastet. Elektronene forble beskrev baner rundt seg, hvilket sol miniatyrsystem.
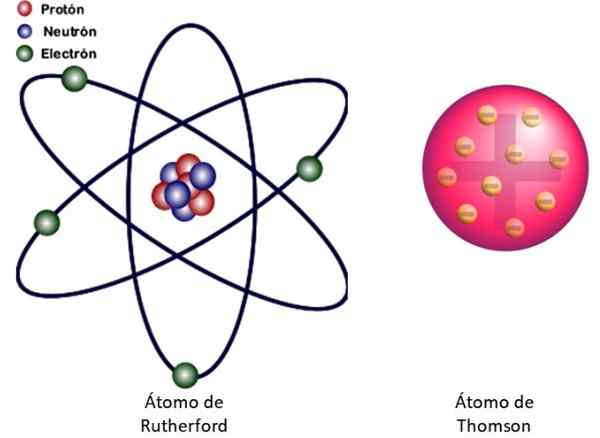 Figur 3. Til venstre for atommodellen til Rutherford og til høyre for Buddin -typen -modellen til Thomsons. Kilde: Wikimedia Commons. Venstre bilde: JCYMC90 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Figur 3. Til venstre for atommodellen til Rutherford og til høyre for Buddin -typen -modellen til Thomsons. Kilde: Wikimedia Commons. Venstre bilde: JCYMC90 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Dette er atommodellen til atomet vist i figur 3 til venstre. Siden elektroner er veldig, veldig små også, viser det seg at atomet er nesten alt .. . tømme! Derfor krysser de fleste alfapartikler arket uten å avvike bare.
Og analogien med et miniatyr solsystem er veldig vellykket. Atomkjernen spiller solens rolle, som inneholder nesten hele massen pluss den positive belastningen. Elektronene går i bane rundt dem som planetene og bærer den negative belastningen. Settet er elektrisk nøytralt.
Om fordelingen av elektroner i atomet, viste Rutherfords eksperiment ingenting. Det kan antas at alfapartikler ville ha noe samspill med dem, men massen av elektroner er for liten og ikke klarte å avleder partiklene betydelig.
Ulemper i Rutherford -modellen
Et problem med denne atommodellen var nettopp oppførselen til elektroner.
Hvis disse ikke var statiske, men kretser om atomkjernen i sirkulære eller elliptiske baner, regissert av den elektriske attraksjonen, ville de ende opp med å skynde seg til kjernen.
Dette er fordi akselererte elektroner mister energi, og hvis det skjer, ville det være atomets kollaps og materie.
Heldigvis er det ikke det som skjer. Det er en slags dynamisk stabilitet som unngår kollaps. Den neste atommodellen, etter Rutherfords, var den av Bohr, som ga noen svar på hvorfor atomkollapsen ikke forekommer.
Protonet og nøytronet
Rutherford fortsatte å gjøre spredningseksperimenter. Mellom 1917 og 1918 valgte han og hans assistent William Kay å bombe.
Det ble overrasket igjen, når det oppdaget hydrogenkjerner. Dette er reaksjonsligningen, den første kunstige kjernefysiske transmutasjonen oppnådd aldri:
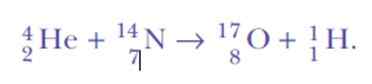 Vel, hvis alfa -partikler er heliumkjerner, hvor kan hydrogenkjerner komme fra?
Vel, hvis alfa -partikler er heliumkjerner, hvor kan hydrogenkjerner komme fra?
Svaret var: fra samme nitrogen. Rutherford hadde tildelt hydrogenatomisk nummer 1, for å være det enkleste elementet av alle: en positiv kjerne og et negativt elektron.
Rutherford hadde funnet en grunnleggende partikkel han kalte Proton, et navn avledet fra det greske ordet til først. På denne måten er protonet en essensiell bestanddel av hver atomkjerne.
Kan tjene deg: volumSenere, i 1920, foreslo Rutherford at det skulle være en nøytral partikkel og med en masse som er veldig lik den av proton. Han kalte denne partikkelen Neutron og er en del av nesten alle kjente atomer. Fysikeren James Chadwick identifiserte den til slutt i 1932.
Hvordan er en skalamodell av hydrogenatom?
Hydrogenatom er, som vi har sagt, det enkleste av alle. Det var imidlertid ikke lett å utdype en modell for dette atomet.
Påfølgende funn ga opphav til kvantefysikk og en hel teori som beskriver atomnivåfenomenene. Under denne prosessen utviklet atommodellen seg også. Men la oss se spørsmålet om størrelser litt:
Hydrogenatom har en kjerne sammensatt av et proton (positivt) og har et enkelt elektron (negativt).
Radiusen til hydrogenatom er estimert til 2.1 x 10-10 m, mens protonet er 0.85 x 10 -femten m eller 0.85 femtometre. Navnet på denne lille enheten skyldes Enrico Fermi og brukes mye når du jobber i denne skalaen.
Vel, kvotienten mellom atomets radius og kjernen er i størrelsesorden 105 M, det vil si at atomet er 100 000 ganger større enn kjernen!.
Vi må imidlertid huske på at elektronet i den moderne modellen, basert på kvantemekanikk, involverer kjernen i en slags sky som kalles orbital (En orbital er ikke en bane) og elektronet, i en atomskala, er ikke punktlig.
Hvis hydrogenatom er vidt utvidet - til størrelsen på en fotballbane, ville kjernen sammensatt av et positivt proton være størrelsen på en maur i midten av feltet, mens det negative elektronet ville være som et slags spøkelse, spredt over hele feltet og omgir den positive kjernen.
Atommodellen i dag
Denne "planetariske" atommodellen er veldig forankret og er bildet som de fleste har fra atomet, siden det er veldig enkelt å visualisere. derimot, det er ikke Modellen som ble akseptert i dag i det vitenskapelige feltet.
Moderne atommodeller er basert på kvantemekanikk. Hun påpeker at elektronet i atomet ikke er et lite punkt med negativ belastning som følger presise baner, slik som de som Rutherford forestiller seg.
Tvert imot, elektronet er spredt I områder, rundt den positive kjernen, kalt Atomic orbitals. Fra ham kan vi vite sannsynlighet å møtes i en eller annen stat.
Til tross for dette betydde Rutherford -modellen et stort fremskritt i kunnskapen om atomets indre struktur. Og de raidet veien for flere forskere å fortsette å perfeksjonere det.
Referanser
- Andriessen, m. 2001. HSC -kurs. Fysikk 2. Jacaranda HSC Science.
- Arfken, g. 1984. Universitetsfysikk. Akademisk presse.
- Knight, r. 2017. Fysikk for forskere og ingeniørfag: En strategitilnærming. Pearson.
- Fysikk Openlab. Rutherford-Geiger-Marsden-eksperimentet. Gjenopprettet fra: Physicsopenlab.org.
- Rex, a. 2011. Fundamentals of Physics. Pearson.
- Tyson, t. 2013. Rutherford -spredningseksperimentet. Gjenopprettet fra: 122.Fysikk.Ucdavis.Edu.
- XAKTLY. Rutherfords eksperimenter. Gjenopprettet fra: xaktly.com.
- Wikipedia. Rutherford -eksperiment. Gjenopprettet fra: det er.Wikipedia.org.
- « Autotroph ernæringsegenskaper, stadier, typer, eksempler
- Anna Freud -biografi, teorier, forsvarsmekanismer, verk »

