Fortynningsfaktor
- 1040
- 81
- Daniel Skuterud
 Seriell fortynning
Seriell fortynning Hva er fortynningsfaktoren?
Han Fortynningsfaktor (FD) er et tall som indikerer tidene for at en løsning må fortynnes for å oppnå en lavere konsentrasjon. Løsningen kan ha oppløst enten et fast, flytende eller gassoppløselig stoff.
Derfor avhenger konsentrasjonen av antall partikler i oppløsningen og det totale volumet V.
Innen kjemi brukes mange konsentrasjonsuttrykk: prosent, molar (m), normal (n), blant andre. Hver av dem er avhengig av en begrenset mengde løst; Fra gram, kilo eller føflekker til tilsvarende.
Når du reduserer slike konsentrasjoner, gjelder FD imidlertid alle disse uttrykkene.
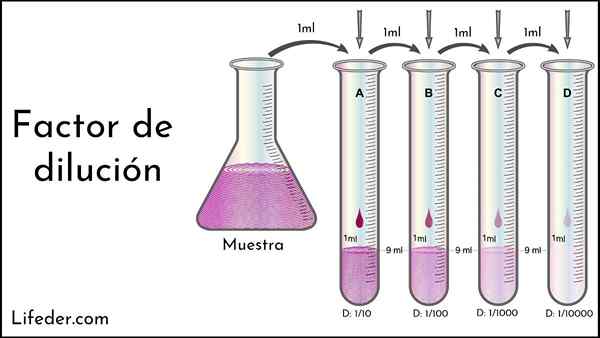
I det overlegne bildet er det et eksempel på en påfølgende fortynning. Merk at fra venstre til høyre blir den fiolette fargen tydeligere; som er lik en lavere konsentrasjon av prøven.
Fortynningsfaktoren gjør det mulig å bestemme hvor fortynnet det siste fartøyet er plassert med hensyn til det første. I stedet for enkle organoleptiske egenskaper kan eksperimentet således gjentas fra samme FD fra den samme flasken med morsoppløsning eller prøve, slik at det sikres at konsentrasjonene til de nye karene er like.
Konsentrasjonen kan uttrykkes i en hvilken som helst enhet; Imidlertid er volumet på fartøyene konstant, og for å lette beregningene brukes det ganske enkelt til volumene av prøven oppløst i vann. Summen av disse vil være lik V: volumet av total væske i glasset.
Som med eksempelprøven, skjer det i laboratoriet med ethvert annet reagens. Konsentrerte mødres løsninger er utarbeidet, hvorav alikvoter blir tatt, og utvannet for å oppnå mer utvannede løsninger. Dette søker å redusere laboratoririsiko og reagens tap.
Hva er fortynningsfaktoren?
Fortynning
Fortynning er en prosedyre som tillater reduksjon i konsentrasjonen av en løsning eller dens tetthet. Handlingen for å redusere fargeintensiteten i en fargestoffløsning kan også betraktes som en fortynning.
For å utvanne en løsning på en viss konsentrasjon, er det første som må gjøres å vite hvor mange ganger konsentrasjonen av morsløsningen er større i forhold til konsentrasjonen av den fortynnede løsningen.
Det kan tjene deg: kaliumdikromat: formel, egenskaper, risikoer og bruksområderDermed må de innledende løsningen fortynnes for å oppnå en løsning med ønsket konsentrasjon. Antall ganger er det som kalles fortynningsfaktoren. Og dette består i en dimensjonsløs brøkdel, noe som indikerer en fortynning.
Faktorer
Det er vanlig å finne en fortynning uttrykt, for eksempel som følger: 1/5, 1/10, 1/100 osv. Dette indikerer at for å oppnå en løsning med ønsket konsentrasjon, er morsløsningen som nevneren til den navngitte brøkdelen.
Hvis for eksempel 1/5 fortynning brukes, må den opprinnelige løsningen fortynnes for å oppnå en løsning med denne konsentrasjonen 5 ganger. Derfor er nummer 5 fortynningsfaktoren. Dette oversettes som følger: 1/5 -løsningen er fem ganger mer utvannet enn moren.
Hvordan forberede denne løsningen? Hvis det tas 1 ml av morsoppløsningen, må dette volumet være kvintubles, slik at konsentrasjonen av løst stoff blir fortynnet med en 1/5 faktor. Så hvis det skal fortynnes med vann (som i eksemplet), bør 1 ml av denne løsningen tilsettes 4 ml vann (1+4 = 5 ml sluttvolum VF).
Deretter vil det bli kommentert hvordan du kan utlede og beregne FD.
Hvordan får du fortynningsfaktoren?
Fradrag
For å fremstille en fortynning blir en innledende løsning eller mor ført til en forverret kolbe, der vann tilsettes for å fullføre kapasiteten til mål på den nevnte kolben.
I dette tilfellet, når vann tilsettes den aggorerte kolben, tilsettes ikke massen av oppløsningen. Deretter forblir massen av oppløsning eller løsningen konstant:
mYo = mF (1)
mYo = masse av den første oppløpet (i den konsentrerte løsningen).
Og MF = masse av den endelige løsningen (i den utvannede løsningen).
Men, m = v x c. Erstatt i ligning (1), har du:
VYo x cYo = VF x cF (2)
VYo = volum av mor eller første løsning som ble tatt til fortynning.
CYo = Konsentrasjon av moren eller den første løsningen.
VF = volum av den utvannede løsningen som ble fremstilt.
CF = konsentrasjon av den fortynnede løsningen.
Ligning 2 kan skrives som følger:
CYo / CF = VF / VYo (3)
To gyldige uttrykk for FD
Men cYo / CF Per definisjon er Fortynningsfaktor, Siden det indikerer tidene at konsentrasjonen av mor eller innledende løsning er større i forhold til konsentrasjonen av den fortynnede løsningen.
Indikerer derfor at fortynningen skal utføres for å fremstille løsningen som er fortynnet fra morsløsningen.
Kan tjene deg: destillert vannPå samme måte fra observasjonen av ligning 3 kan det konkluderes med at forholdet VF / VYo Det er en annen måte å få tak i Fortynningsfaktor. Det vil si at en av de to uttrykkene (CYo/CF, VF/VYo) er gyldige for å beregne FD. Bruken av det ene eller det andre vil avhenge av tilgjengelige data.
Eksempler
Eksempel 1
En 0,3 M NaCl -løsning ble brukt til å fremstille en utvannet oppløsning på 0,015 m. Beregn fortynningsfaktorverdien.
Fortynningsfaktoren er 20. Dette indikerer at for å fremstille den fortynnede løsningen av NaCl 0,015 m, måtte 0,3 M NaCl -løsningen fortynnes 20 ganger:
FD = cYo / CF
0,3 m / 0,015 m
tjue
Eksempel 2
Å vite at fortynningsfaktoren er 15: Hvilket volum vann som skal tilsettes 5 ml av en konsentrert glukoseløsning for å lage ønsket fortynning?
Som første trinn beregnes volumet av den fortynnede løsningen (vF). Når det er beregnet, beregnes det ekstra vannvolumet for å gjøre fortynningen.
Fd = VF / VYo.
VF = FD X VYo
15 x 5 ml
75 ml
Lagt vannvolum = 75 ml - 5 ml
70 ml
For å fremstille den fortynnede løsningen med en fortynningsfaktor på 15, 5 ml fra den konsentrerte oppløsningen ble 70 ml vann tilsatt for å fullføre det endelige volumet på 75 ml.
Eksempel 3
Konsentrasjonen av en fruktosemorløsning er 10 g/l. Det er ønsket å fremstille en fruktoseoppløsning med en konsentrasjon på 0,5 mg/ml. Tar fra 20 ml mors løsning for fortynning: hva som skal være volumet av den utvannede løsningen?
Det første trinnet for å løse problemet er å beregne fortynningsfaktoren (FD). Når den er oppnådd, blir volumet av den fortynnede løsningen beregnet (VF).
Men før du foretar beregningen som er hevet, er det nødvendig å gjøre følgende observasjon: Du må plassere mengdene av fruktosekonsentrasjoner i de samme enhetene. I dette tilfellet tilsvarer 10 g/l 10 mg/ml, noe som illustrerer denne situasjonen gjennom følgende transformasjon:
(mg/ml) = (g/l) x (1.000 mg/g) x (l/1.000 ml)
Derfor:
10 g/l = 10 mg/ml
Fortsetter med beregningene:
Kan tjene deg: aminerFD = cYo / CF
FD = (10 mg/ml)/(0,2 mg/ml)
femti
Men som vF = FD X VYo
VF = 50 x 20 ml
1.000 ml
Så 20 ml av 10 g/l fruktoseoppløsningen, 1L 0,2 g/l -løsning ble fortynnet.
Eksempel 4
En metode for å lage serielle fortynninger vil bli illustrert. Det er en glukoseløsning med en konsentrasjon på 32 mg/100 ml, og fra den er den ønsket/100 ml, 2 mg/100 ml og 1 mg/100 ml.
Fremgangsmåte
5 Testrør er merket for hver av konsentrasjonene som er angitt i uttalelsen. I hver og hver plasseres for eksempel 2 ml vann.
Så til rør 1 med vann, tilsettes 2 ml av morsoppløsningen. Innholdet i rør 1 omrøres og 2 ml av innholdet overføres til rør 2. På sin side er rør 2 omrørt og 2 ml av innholdet overføres til rør 3; Fortsetter på samme måte med rør 4 og 5.
Forklaring
Til rør 1 tilsettes 2 ml vann og 2 ml av morsløsningen med en glukosekonsentrasjon på 32 mg/100 ml. Så den endelige glukosekonsentrasjonen i dette røret er 16 av mg/100 ml.
Til rør 2 tilsettes 2 ml vann og 2 ml av innholdet av rør 1 med en 16 mg/100 ml glukosekonsentrasjon. Deretter, i rør 2, blir konsentrasjonen av rør 1 fortynnet 2 ganger (FD). Så den endelige konsentrasjonen av glukose i dette røret er 8 mg/100 ml.
Til rør 3 2 ml vann og 2 ml rør 2 innhold tilsettes, med en glukosekonsentrasjon på 8 mg/100 ml. Og som de to andre rørene, er konsentrasjonen delt i to: 4 mg/100 ml glukose i rør 3.
Av den grunn forklart ovenfor, er den endelige konsentrasjonen av glukose i rør 4 og 5 henholdsvis 2 mg/100 ml og 1 mg/100 ml.
FD av rør 1, 2, 3, 4 og 5, i forhold til mors løsning, er: henholdsvis 2, 4, 8, 16 og 32.
Referanser
- Aus og tute. (s.). Fortynningsfaktorberegninger. Hentet fra: ausetute.com.Au
- J.T. (s.F.). Fortynningsfaktor. [PDF]. Hentet fra: csus.Edu
- Fortynninger hjelper (s.F.). Hentet fra: Uregina.Ac
- Joshua (2011). Forskjell mellom fortynning og fortynningsfaktor. Forskjell mellom.nett. Gjenopprettet fra: forskjell mellom.nett
- Whitten, Davis, Peck & Stanley. Kjemi (8. utg.). Cengage Learning.
- Innovarte (2014). Serielle fortynninger. Hentet fra: 3.Uah.er

