Kaliumfluorid (KF)
- 742
- 9
- Anders Mathisen
 Kaliumfluoridstruktur. Kilde: Benjah-BMM27, Wikimedia Commons
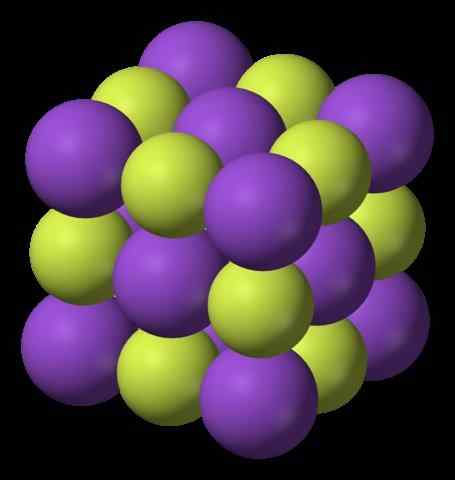
Kaliumfluoridstruktur. Kilde: Benjah-BMM27, Wikimedia Commons Hva er kaliumfluorid?Han Kaliumfluorid Det er et uorganisk halogenid som består av et salt dannet mellom metall og halogen. Dens kjemiske formel er KF, som betyr at for hver kation k+ Det er en f- av motstykke. Interaksjonene er elektrostatiske, og som et resultat er det ingen K-F kovalente koblinger.
Dette saltet er preget av dets ekstreme løselighet i vann, så det danner hydrater, absorberer fuktighet og er deilig. Derfor er det veldig enkelt å fremstille vandige oppløsninger av det, som fungerer som en kilde til fluoranioner for alle syntese der det er ønsket å innlemme det i en viss struktur.
Ki produseres ved å reagere kaliumkarbonat med fluorhorinsyre, og produserer kaliumbifluorid (KHF2), som på grunn av termisk nedbrytning ender opp med å forårsake kaliumfluorid.
Kaliumfluoridstruktur
Det øvre bildet viser strukturen til kaliumfluorid. De lilla kulene representerer kationer k+, Mens de gulaktige kulene representerer anioner f-.
Merk at arrangementet er kubisk og tilsvarer en gema -saltstruktur, veldig lik den for natriumklorid. Alle sfærer er omgitt av seks naboer, som utgjør en oktaedron KF6 eller fk6, det vil si hver k+ Det er omgitt av seks f-, Og det samme gjelder omvendt.
Det ble tidligere nevnt at KF er hygroskopisk og derfor absorberer miljøet i miljøet. Dermed ville arrangementet som vises samsvare med den vannfrie formen (uten vann) og ikke til dens hydrater, som absorberer så mye vann at til og med solubiliserer og "smelter" (avdelingercence).
Kan tjene deg: neon: historie, egenskaper, struktur, risiko, brukHydrater
De krystallinske strukturer av hydrater blir mindre enkle. For nå griper vannmolekylene direkte inn i arrangementene og samhandler med K -ionene+ og f-. En av de mest stabile hydratene er KF · 2H2O y kf · 4h2ENTEN.
I begge hydrater er den nylig nevnte oktaedra deformert på grunn av vannmolekylene. Dette skyldes hovedsakelig hydrogenbroer mellom f- og h₂o (f--HOH). Krystallografiske studier har bestemt at til tross for dette fortsetter de to ionene å opprettholde samme antall naboer.
Som et resultat er den originale kubiske strukturen for vannfri kaliumfluorur.
Anhydros deler delikatøren.
Kaliumfluoridegenskaper
- Molekylær vekt: 58.097 g/mol.
- Fysisk utseende (farge): Hvite kubikkkrystaller eller avveising av krystallinsk støv.
- Smak: akutt saltvannsmak.
- Kokepunkt: 2.741 ° F ved 760 mmHg (1502 ° C). I flytende tilstand blir det en leder av strøm, selv om anionene f kan- Ikke samarbeid i samme grad for å kjøre som k+.
- Smeltepunkt: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). Dette er en indikasjon på dets sterke ioniske koblinger.
- Løselighet: Løselig i HF, men uoppløselig i alkohol. Dette viser at hydrogenbroer mellom fluor og alkoholer, f--Hor, de favoriserer ikke solvasjonsprosessen mot oppløsningen av det krystallinske nettverket.
- Vannløselighet: vannfri 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihydrared 349,3 g/100 ml (18 ° C). Det vil si at når KF er hydrert, blir den mer løselig i vann.
- Tetthet: 2,48 g/cm3.
- Damptrykk: 100 kPa (750 mm Hg) ved 1.499 ° C.
- Nedbrytning: Når han blir oppvarmet til nedbrytning, avgir han en giftig røyk fra kaliumoksyd og hydrogenfluorid.
- Etsende handling: En vandig løsning korroderer glass og porselen.
- Flashpoint: Det er ikke et brennbart stoff
- Eksperimentell refraksjonsindeks (ηd): 1.363.
- Stabilitet: Stabil hvis det er beskyttet mot fuktighet, siden ellers er faststoffet oppløst. Uforenlig med sterke syrer og baser.
Kaliumfluoridbruk
- Juster pH: Vandige kaliumfluoridløsninger brukes i industrielle anvendelser og prosesser. For eksempel tillater KF -løsninger pH å justeres i produsentene som utføres i tekstilbehandling og vaskerom (de tilnærmer en verdi på 7).
- Fluorkilde: Kaliumfluorid er, etter hydrogenfluorid, hovedkilden for å oppnå fluor. Dette elementet brukes i kjernefysiske planter og i produksjon av uorganiske og organiske forbindelser, noen med bruksområder som deres inkorporering i Dentifriques.
- Fluorocarbone -syntese: Kaliumfluorid kan brukes i syntesen av fluorben eller fluorkarbid fra klorokarbon, ved å bruke Fanteistein -reaksjon. I denne reaksjonen brukes etylenglykol og dimetylsulfoksyd som løsningsmidler.
- Fluorinering: Som en fluorinkilde der den ligger oppløst i vann, fra løsningene deres kan de syntetisere komplekse fluorider, det vil si at de er innlemmet med F- til strukturer. Et eksempel er i følgende kjemiske ligning:
Mnbr2(Ac) + 3kf (Ac) => KMNF3(S) + 2KBR (AC)
- Deretter utfeller KMNFs blandede fluor3. Dermed kan f legges til- å være en del av et komplekst metallsalt. I tillegg til mangan, kan fluor av andre metaller skynde seg: KCOF3, KFEF3, Knif3, KCF3 og KZNF3.
- På samme måte kan fluor kovalent inkorporeres i en aromatisk ring, og syntetisere organisatoriske.
- Flere: KF brukes som mellomliggende eller råmateriale for syntese av forbindelser som hovedsakelig brukes i agrokjemi eller plantevernmiddelprodukter.
- I tillegg brukes det som et grunnleggende middel for sveising.
Referanser
- Kaliumfluorid. Gjenopprettet fra ChemicalBook.com.
- Kaliumfluorid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.

