Galvanoplastikk

- 2081
- 312
- Anders Mathisen
Vi forklarer hva galvanoplastikk består av, også kalt elektroavsetning, hvordan er dens prosess, praktiske eksempler og dens anvendelser.
 Galvanoplastikk av en skje
Galvanoplastikk av en skje Hva er galvanoplastikk?
Galvanoplastikk eller elektroavsetning er en elektrokjemisk teknikk som består, som navnet antyder, ved å avsette lag med metaller på mottak av objekter; Det vil si å dekke dem fra et metalldeksel, hvis tykkelse varierer mellom 5-20 μm.
Denne teknikken er også kjent som elektrokapado eller elektrolytisk belagt, som et elektrolytisk medium sammensatt av metallioner av metallet som er ønsket å avsette er uunnværlig for implementeringen. Derfor, hvis vi vil ha en kobberbelagt (kobber), trenger vi kobberoppløselige salter, for eksempel kobbersulfat, oppløst i vann.
Den forrige resonnementet gjelder for ethvert annet metall: en gullelektrolytisk belagt vil kreve gullsalter, vanligvis gullcyanider, som kan bli veldig giftige. Dermed kan noen gjenstander, for eksempel spisedommer, belegges med gull for å tilordne større verdi og adel.
Men galvanoplastikk går utover estetikk: de blir overført. Det tillater også å spare naturressurser, siden det ikke er nødvendig å bruke store mengder metall til belegg.
Galvanoplastikkprosess
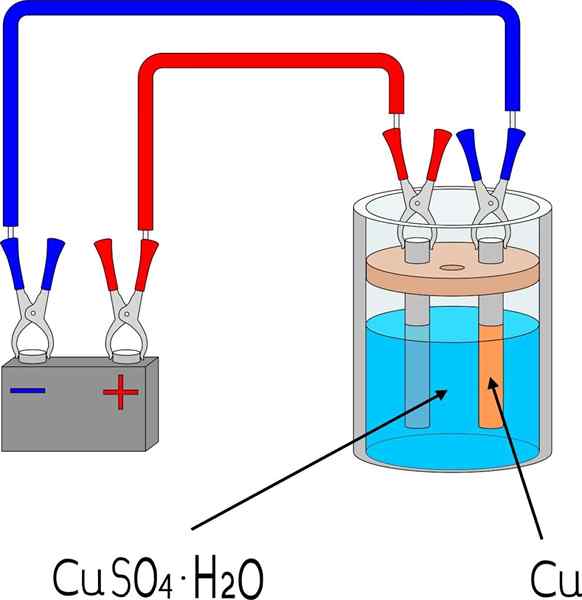 Kobberelektroavsetning i et kobbersulfatbad
Kobberelektroavsetning i et kobbersulfatbad Gjenstander
For å elektrodeponere et metall på en overflate, er det behov for noen grunnleggende elementer, hvis dimensjoner og modus vil variere avhengig av partiet med objekter som skal dekkes.
I det øvre bildet, for eksempel, vises små kobberelektrode, reproduserbar i et hvilket som helst laboratorium eller rom.
Elektrolytisk medium
For det første er et elektrolyttmedium av metallet til elektroavsetning nødvendig. Kobbersulfatsalt, cuo4, Det er veldig løselig i vann, så det bringer ioner Cu2+ som deretter vil bli redusert til atomer Cu0. Disse atomene er de som vil bli samlet på den mottakende overflaten for å gi opphav til metallkrystaller.
Det elektrolytiske mediet er uunnværlig for kretsen å fungere og ioniske belastninger kan bevege seg eller mobilisere mot regionen der elektroavsetning oppstår.
Elektroder
Elektrodene er overflatene som elektroavsetningen foregår fra den kjemiske basen. Enkelt sagt er det to elektroder: katoden, som er her metallet er elektrodepos; Og anoden, som er der en kjemisk reaksjon finner sted som donerer elektroner til metallionene som vil dekke katoden.
Det kan tjene deg: uretan: struktur, egenskaper, innhenting, brukDet vil si at katoden blir stykket som er ønsket. I mellomtiden er anoden en hvilken som helst overflate som en art oksiderer og donerer elektronene til katoden. Mange ganger er anoden laget av det samme metallet som er oppløst i det elektrolytiske miljøet. Hvis det er kobberionisk i midten, vil anoden i dette tilfellet være metallisk kobber.
Ekstern krets
Den eksterne kretsen er et batteri som gir de første elektronene som fremmer elektroavsetning. Tilstedeværelsen betyr at reaksjonen ikke er spontan: elektrisitet er nødvendig for å generere en kjemisk endring, som er reduksjon av oppløst metallioner.
Elektrode rengjøring
Stykket som skal dekkes må være helt rent. Ellers vil den belagt eller belegget være mangelfullt.
For å gjøre dette, må du sørge for at overflaten er helt hydrofil, det vil si at den ikke har fett eller noe skitt. En måte å sikre dette, etter kjemisk vask, er å våte stykket med vann, og hvis dannelsen av vanndråper eller en ikke -ulik væskedråpe blir observert, betyr det at elektroden ikke er ren ennå.
Reaksjoner og betydning av elektroner
Galvanoplastikk er en redoksreaksjon. Derfor: den ene arten må reduseres, mens den andre oksiderer, eller omvendt. I kobberet har vi en anode laget av kobber, og en katode laget av et metall meg (jern, sink, tinn, etc.).
Når vi slår på batteriet, vil de strømme elektroner til katoden, som begynner å lade negativt.
Den negative belastningen på katoden tiltrekker seg kationer Cu2+ av det elektrolytiske miljøet, som finner sted reduksjonen:
Cu2+(AC) +2E- → Cu (er)
Det kan tjene deg: Maillard -reaksjonBatteriet må gjenopprette de donerte elektronene, og også ionene Cu må utvinnes2+ redusert for å opprettholde nøytraliteten i det elektrolytiske miljøet. Dette er når anoden kommer i funksjon: Kobberatomer oksiderer:
Cu (er) → cu2+(AC) +2E-
Og de frigjorte elektronene blir rettet tilbake til batteriet, som igjen mobiliserer dem mot katoden for å fortsette elektroavsetningen.
Anoden får positiv belastning, som tiltrekker SO -ioner42- av det elektrolytiske mediet (se bilde igjen).
Det vil si at reaksjonene som oppstår er reduksjon og oksidasjon av kobber, metallet som er elektrodepos:
Cu2+(AC) +2E- → Cu (er)
Cu (er) → cu2+(AC) +2E-
Anoden, av kobber, mister deigen mens katoden, av et annet metall, er dekket med et fint koppelag.
Eksempler på galvanoplastikk
Sølv
Metaller kan være "elektroplate", som elektrolytisk dekker dem fra et sølvlag. Dette er spesielt gunstig i elektroniske komponenter som må utføre strøm. Sølv kan være elektrodeposita på stål, kobber, nikkel og andre metaller.
Tinnet
Tinneren er elektroavsetning av tinn. Det er veldig nyttig i produksjonen av jernbokser, som er dekket med tinn for å gjøre dem motstandsdyktige mot korrosjon, og dermed ikke skade maten eller produktene som lagrer.
Latin eller solbrun
Selv om det er litt mer forseggjort, kan messing og bronse også være elektrodepoer på noen metaller for å forbedre utseendet.
Zincado
Sink eller sink galvanoplastikk (ikke forvirrende med termisk galvanisert) brukes mest til å gi jernmotstand mot korrosjon og lysere og mer attraktive overflater. Dermed er funksjonen estetisk og samtidig funksjonell, og finnes i kroppsdeler som hjulene.
Metallplast
Plast, tidligere behandlet for å ha en ledende overflate, kan også dekkes med metall, som er som om de ble festet til et ark aluminiumsfolie.
Kan tjene deg: Kitasato FlaskGalvanoplasty -applikasjoner
Galvanoplastikk eller elektroavsetningsapplikasjoner kan deles inn i funksjonelle eller estetiske.
Funksjonell
 En tynn elektrodepos av gull hos seerne av tilfellene av astronauter lar dem beskytte øynene mot sollys
En tynn elektrodepos av gull hos seerne av tilfellene av astronauter lar dem beskytte øynene mot sollys Belegg et stykke eller et objekt er å gi overflaten med egenskaper som alene mangler. For eksempel lager kobber- eller gullelektrodusering brikkene de har, så det er ideelt i elektroniske kretsløp å dra nytte av egenskapene til disse metallene, uten behov for å bruke mange gull på fremstilling av hele og faste stykker.
Gull beskytter derimot varme- og strålingsflater. Det er av denne grunn at det er mye brukt i satellittene og i hjelmer til astronautene, siden det gjenspeiler sollyset, og dermed fører øynene, eller raskt varme.
Krom eller nickled stål er veldig motstandsdyktige mot korrosjon takk nettopp til disse metalllagene. Det er grunnen til at galvanoplastikk brukes i bransjen for å beskytte metaller som er følsomme for korrod.
Estetikk
Metalliske finér skinner. Sink, nikkel og krom brukes mye til dette formålet. Gull og sølv er også elektrodepoer i ringer, kjeder, armbånd, chokers, bakker, etc., Og derfor finner galvanoplastikken mange applikasjoner i smykkebutikker og ornamentasjoner, for å forbedre bildet og prestisjen til disse plaggene.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2021). Elektroplatering. Hentet fra: i.Wikipedia.org
- Chris Woodford. (28. juli 2020). Hvordan elektroplatering fungerer. Hentet fra: Explinthatstuff.com
- Rob Snyder. (s.F.). Nanoskala elektroavsetning. STEM Education Institute. [PDF]. Gjenopprettet fra: Nanoskala.UNL.Edu
- Elsevier f.V. (2021). Elektroavsetning. Scientedirect. Hentet fra: Scientedirect.com
- Vaishali Mittal. (10. desember 2020). Elektroplatering. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Singh Davneet. (9. juni 2020). Forskjellige typer elektropling. Gjenopprettet fra: lære.com
- Helmestine, Anne Marie, PH.D. (26. august 2020). Hva er elektroplikering og hvordan fungerer det? Gjenopprettet fra: Thoughtco.com

