Karbonylgruppeegenskaper, egenskaper, nomenklatur, reaktivitet
- 1054
- 264
- Prof. Theodor Gran
Han Karbonylgruppe Det er en organisk og oksygenert funksjonell gruppe som ligner karbonmonoksidgassmolekylet. Det er representert som C = O, og selv om det anses som organisk, kan den også finnes i uorganiske forbindelser; Som kullsyre, h2Co3, eller i organometalliske forbindelser med CO som binding.
Imidlertid er det i karbonkjemi, liv, biokjemi og andre analoge vitenskapelige grener der denne gruppen skiller seg ut av sin enorme betydning. Hvis det ikke var for ham, kunne mange molekyler ikke samhandle med vann; Proteiner, sukker, aminosyrer, fett, nukleinsyrer og andre biomolekyler ville ikke eksistere hvis det ikke var for det.
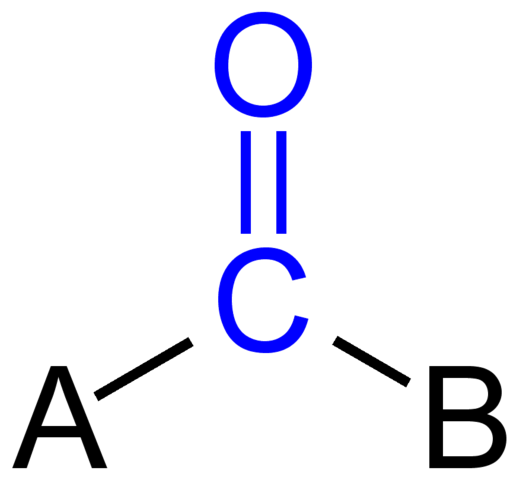
 Karbonylgruppe. Kilde: Jü [Public Domain]
Karbonylgruppe. Kilde: Jü [Public Domain] Det øvre bildet viser hvordan denne gruppen ser ut i det generelle skjelettet til en forbindelse. Merk at det fremheves av fargen blå, og hvis vi fjernet erstatningene A og B (R eller R ', like gyldig), ville det være et molekyl med karbonmonoksid. Tilstedeværelsen av disse substituentene definerer et stort antall organiske molekyler.
Hvis A og B er karbonatomer, for eksempel metaller eller ikke -metalliske elementer, kan organometalliske eller uorganiske forbindelser gjøres. Når det.
Dermed begynner det å forstå hvorfor karbonylgruppen er ganske vanlig for de som studerer naturlige eller helsevitenskap; Det er overalt, og uten det ville ikke molekylære mekanismer som skjer i cellene våre oppstå.
Hvis relevansen kan oppsummeres, vil det bli sagt at den gir polaritet, surhet og reaktivitet til et molekyl. Der det er en karbonylgruppe, er det mer enn sannsynlig at bare på det tidspunktet kan molekylet lide en transformasjon. Derfor er det et strategisk sted å utvikle organisk syntese gjennom oksidasjoner eller nukleofile angrep.
[TOC]
Karakteristikker og egenskaper til karbonylgruppen
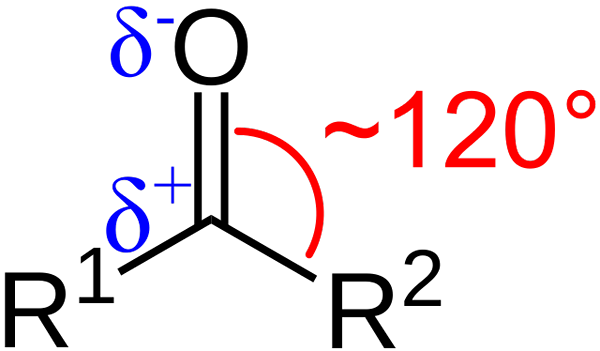 Strukturelle egenskaper ved karbonylgruppen. Kilde: Azaline Gomberg [Public Domain].
Strukturelle egenskaper ved karbonylgruppen. Kilde: Azaline Gomberg [Public Domain]. Hva er de strukturelle og elektroniske egenskapene til karbonylgruppen? Opp1 og r2 I stedet for A og B, som eksisterer mellom substituentene og oksygenatomet en vinkel på 120 ° C; Det vil si at geometri rundt denne gruppen er trigonal flat.
Hva er geometrien slik2; Dermed vil karbon ha tre SP -orbitaler2 Å danne enkle kovalente koblinger med r1 og r2, og en orbital p ren for å etablere dobbeltbinding med oksygen.
På denne måten forklares det hvordan det kan være en dobbeltbinding c = o.
Hvis bildet blir observert, vil det også sees at oksygen har større elektronisk tetthet, Δ-, enn karbon, Δ+. Dette er fordi oksygen er mer elektronegativt enn karbon, og derfor "stjeler" elektronisk tetthet; Og ikke bare for ham, men også til substituentene r1 og r2.
Følgelig genereres et permanent dipolmoment, som kan være i større eller mindre størrelse avhengig av molekylstrukturen. Der det er en karbonylgruppe, vil det være dipolmomenter.
Resonansstrukturer
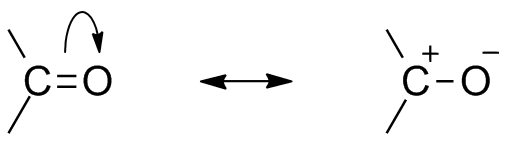 De to resonansstrukturene for denne organiske gruppen. Kilde: Mfomich [CC0]
De to resonansstrukturene for denne organiske gruppen. Kilde: Mfomich [CC0] En annen konsekvens av elektronegativiteten til oksygen er at det i karbonylgruppen er resonansstrukturer som definerer en hybrid (kombinasjonen av de to strukturene i det overlegne bildet). Merk at elektronparet kan migrere til orbitalen p av oksygen, som etterlater karbonatomet med en positiv delvis belastning; En karbokasjon.
Kan tjene deg: Cycloalcanos: Egenskaper, reaksjoner, bruksområder, eksemplerBegge strukturer skjer konstant, så karbon opprettholder en konstant mangel på elektroner; det vil si for kationer som er veldig nær det, vil de oppleve en elektrostatisk frastøtning. Men hvis det er en anion, eller en art som er i stand til å donere elektroner, vil det føles en sterk attraksjon for dette karbonet.
Så forekommer det som er kjent som det nukleofile angrepet, som vil bli forklart i en neste seksjon.
Nomenklatur
Når en forbindelse har gruppen C = O, sies det at den er karbonyl. Avhengig av arten av karbonylforbindelsen har den således sine egne nomenklaturregler.
Selv om alle deler en regel til felles: C = O har en prioritet i den kullsyreholdig.
Dette betyr at hvis det er konsekvenser, halogenatomer, nitrogene funksjonelle grupper, doble eller trippelkoblinger, kan ingen av dem bære et mindre antall enn C = O; Derfor begynner den lengste kjeden å bli oppført så nær karbonylgruppen.
Hvis det tvert imot er flere C = eller i kjeden, og en av dem er en del av en funksjonell gruppe av større hierarki, vil karbonylgruppen bære en større locator og vil bli nevnt som en OXO -substituent.
Og det som sies hierarki? Følgende, fra høyeste til mindreårig:
-Karboksylsyrer, RCOOH
-Ester, Rcoor '
-Amida, Rconh2
-Aldehyd, RCoh (eller RCHO)
-Cetona, Rcor
Bytte ut R og R 'med molekylære segmenter, uendelige karbonylforbindelser representert av familier ovenfor: karboksylsyrer, estere, amidas, etc. Hver har assosiert sin tradisjonelle nomenklatur eller iupac.
Reaktivitet
Nukleofilt angrep
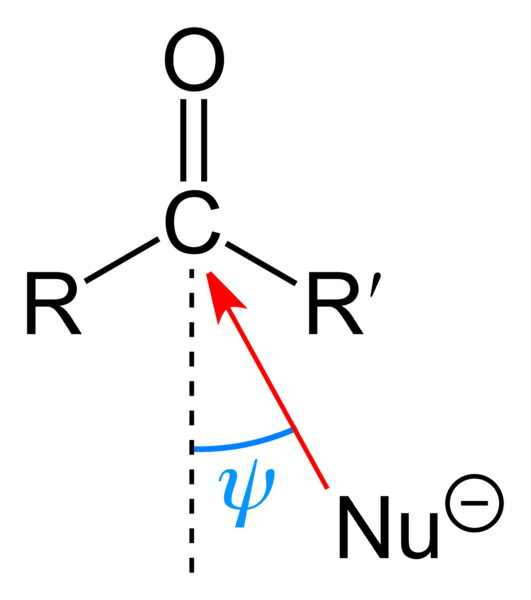 Nukleofilt angrep på karbonylgruppen. Kilde: Benjah-BMM27 [Public Domain]
Nukleofilt angrep på karbonylgruppen. Kilde: Benjah-BMM27 [Public Domain] Det øvre bildet viser at det nukleofile angrepet har påført karbonylgruppen. Nukleofilen, nu-, Det kan være en anion eller en nøytral art med tilgjengelige elektroner; Som ammoniakk, NH3, For eksempel. Dette ser utelukkende ut til karbon fordi det ifølge resonansstrukturer presenterer en positiv delvis belastning.
Positiv belastning tiltrekker seg NU-, som vil søke å nærme seg en "flanke" slik at det er den minste steriske hinderet med substituentene r og r '. Avhengig av hvor klumpete de er, eller størrelsen på samme NU-, Angrepet vil oppstå i forskjellige vinkler ψ; Det kan være veldig åpent eller lukket.
Når angrepet skjer, vil en mellomliggende forbindelse bli dannet, Nu-Cr'-O-; det vil si at oksygen blir med et par elektroner for å la Nu tilsettes- til karbonylgruppen.
Dette negativt belastede oksygenet kan gripe inn i andre trinn i reaksjonen; Proton som hydroksylgruppe, OH, eller frigjør som et vannmolekyl.
Kan tjene deg: partisjonskoeffisient: distribusjon, distribusjon, applikasjonerMekanismene som er involvert, så vel som produktene fra reaksjonen oppnådd ved dette angrepet, er veldig varierte.
Derivater
Det nyutøse agenten NU- Det kan være mange arter. For hver spesifikk for å reagere med karbonylgruppen, forskjellige derivater.
For eksempel når nevnte nukleofilt middel er et amin, NH2A, iminas stammer, r2C = nr; Hvis det er hydroksylamin, NH2Å, resulterer i Oximas, rr'c = noh; Hvis det er cyanidanionen, CN-, Cianohydrinas, rr'c (oh) cn, og dermed med andre arter.
Reduksjon
Til å begynne med ble det sagt at denne gruppen er oksygenert, og derfor rusten. Dette betyr at gitt forholdene kan koblinger reduseres eller mister oksygenatom som erstatter det med hydrogener. For eksempel:
C = o => ch2
Denne transformasjonen indikerer at karbonylgruppen ble redusert til en metylengruppe; Det var hydrogenforsterkning på grunn av oksygentap. I mer passende kjemiske termer: karbonylforbindelsen reduseres til en alkan.
Hvis det er en cetona, rcor ', i nærvær av hydraracina, h2N-nh2, og et sterkt grunnleggende miljø kan reduseres til dens respektive alkan; Denne reaksjonen er kjent som Wolff-Kishner-reduksjon:
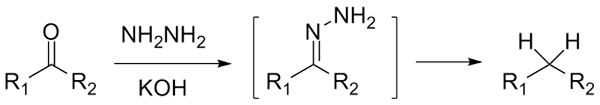 Wolff-Kishner reduksjon. Kilde: Jü [CC0]
Wolff-Kishner reduksjon. Kilde: Jü [CC0] Hvis reaksjonsblandingen på den annen side består av amalgamat -sink og saltsyre, er reaksjonen kjent som klemmensenreduksjon:
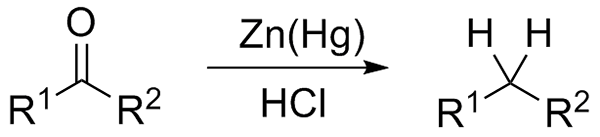 Clemmensen reduksjon. Kilde: Wikimedia Commons.
Clemmensen reduksjon. Kilde: Wikimedia Commons.
Acetal og Ceal Training
Karbonylgruppen kan ikke bare legge til nukleofile midler NU-, Men under syreforhold kan det også reagere med alkoholer gjennom lignende mekanismer.
Når en aldehyd eller cetona delvis reagerer med henholdsvis en alkohol, har hemiacetals eller hemicetals oppstått henholdsvis. Hvis reaksjonen utføres fullstendig, er produktene acetaler og ketaler. Følgende kjemiske ligninger oppsummerer og tydeliggjør de nylig nevnte:
Rcho + r3Oh g rchoh (eller3) (Hemiacetal) + r4Oh g rch (eller3) (Eller4) (Acetal)
Rcor2 + R3Oh g rcor2(Å) (eller3) (Hemisk) + r4Oh g rcor2(Eller3) (Eller4) (Ketal)
Den første reaksjonen tilsvarer dannelsen av hemiacetaler og acetaler fra et aldehyd, og den andre av hemicetaler og ketaler fra en keton.
Disse ligningene er ikke enkle nok til å forklare dannelsen av disse forbindelsene; For en første tilnærming til emnet er det imidlertid nok å forstå at alkoholer tilsettes, og at sidekjedene deres r (r (r3 og r4) De er knyttet til karbonylkarbon. Det er grunnen til eller eller3 og eller4 Til det første molekylet.
Hovedforskjellen mellom en acetal og ketal, er tilstedeværelsen av hydrogenatomet knyttet til karbon. Merk at ketonen mangler dette hydrogenet.
Folkens
Veldig lik som forklart i nomenklaturseksjonen for karbonylgruppen, er dens typer basert på hva som er substituentene a og b, eller r og r '. Derfor er det strukturelle egenskaper som deler en serie karbonylforbindelser utover bare rekkefølgen eller typen koblinger.
For eksempel ble det nevnt nevnte analogi -prinsippet mellom denne gruppen og karbonmonoksid, C≡O. Hvis molekylet er blottet for hydrogenatomer, og hvis det også er to C = O -terminaler, vil det være et karbonoksid, CnENTEN2. For n lik 3, vil du ha:
Kan tjene deg: IsóbarosO = c = c = c = o
Noe som er som om det var to C≡O -molekyler koblet og separert med et karbon.
Karbonylforbindelser kan ikke bare stamme fra CO -gass, men også fra kullsyre, h2Co3 eller oh- (c = o) -oh. Her representerer de to OH R og R ', og erstatter en av dem, eller deres hydrogener, oppnås karbononsyredederivater.
Og så er det derivater av karboksylsyrer, RCOOH, oppnådd ved å endre R -identiteter, eller erstatte H med et annet atom eller kjede R '(som vil gi opphav til en ester, rcoor').
Hvordan identifisere det i aldehydos og ketoner
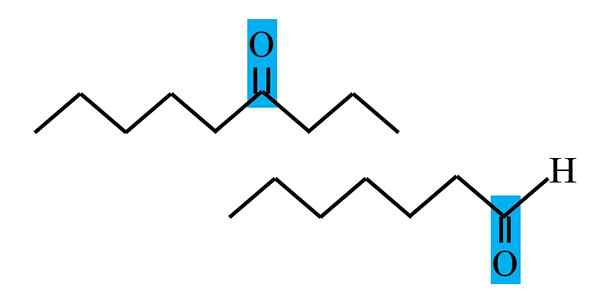 Differensiering av keton og aldehyd fra en strukturell formel. Kilde: Gabriel Bolívar.
Differensiering av keton og aldehyd fra en strukturell formel. Kilde: Gabriel Bolívar. Både aldehydos og ketoner har til felles tilstedeværelsen av karbonylgruppen. Dets kjemiske og fysiske egenskaper skyldes det. Imidlertid er deres molekylære miljøer ikke like i begge forbindelser; I førstnevnte er han i en terminalposisjon, og i sekundene, hvor som helst i kjeden.
I det øvre bildet er for eksempel karbonylgruppen inne i en blåaktig boks. I ketonene, ved siden av denne boksen, må det være et annet karbon- eller kjedesegment (opp ned); Mens det er i aldehyder, kan det bare være et hydrogenatom (nedenfor).
Hvis C = O er i den ene enden av kjeden, vil det være et aldehyd; Det er den mest direkte måten å skille den fra en Cetona.
Id
Men hvordan du vet eksperimentelt hvis en ukjent forbindelse er en aldehyd eller en keton? Det er mange metoder, fra spektroskopisk (infrarød strålingsabsorpsjon, IR) eller organiske kvalitative tester.
Når det gjelder kvalitative essays, er disse basert på reaksjoner som når man gir positive analytikeren vil observere en fysisk respons; En fargeendring, varmeutgivelse, bobleformasjon, etc.
For eksempel å legge til prøven en syreløsning av k2Cr2ENTEN7 Aldehydet vil bli transformert til karboksylsyre, noe som gjør at fargen på løsningen endres fra oransje til grønn (positiv test). I mellomtiden reagerer ikke ketonene, og derfor observerer ikke analytikeren noen fargeendring (negativ test).
En annen studie er å bruke Tollens Reagent, [Ag (NH3)2]+, slik at aldehyden reduserer kationene AG+ til metall sølv. Og resultatet: dannelsen av et sølvspeil i bunnen av testrøret der prøven ble plassert.
Hovedeksempler
Til slutt vil en serie eksempler på karbonylforbindelser bli listet opp:
-Ch3COOH, eddiksyre
-HcoOH, maursyre
-Ch3Coch3, Propanona
-Ch3Coch2Ch3, 2-butanon
-C6H5Coch3, Acetofenon
-Ch3Cho, Etanal
-Ch3Ch2Ch2Ch2Cho, pentanal
-C6H5Cho, benzaldehyd
-Ch3Conh2, Acetamid
-Ch3Ch2Ch2Cooch3, Propylacetat
Nå, hvis eksempler på forbindelser er sitert som ganske enkelt har denne gruppen, vil listen være nesten uendelig.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Reid Danielle. (2019). Karbonylgruppe: Egenskaper og oversikt. Studere. Gjenopprettet fra: Studie.com
- Sharleen Agvateesiri. (5. juni 2019). Karbonylgruppen. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Wiki Kids Ltd. (2018). Karbonylforbindelser. Gjenopprettet fra: enkelt.Vitenskap
- Toppr. (s.F.). Nomenklatur og struktur av karbonylgruppe. Gjenopprettet fra: Toppr.com
- Clark J. (2015). Oksidasjon av aldehyder og ketoner. Gjenopprettet fra: Chemguide.co.Storbritannia
- « José Rubén Romero -biografi, stil, fungerer
- Karbon 12 kjernefysisk notasjon, historie, kommentarer »

