Heliohistorie, egenskaper, struktur, risikoer, bruker

- 2686
- 62
- Jonathan Moe
Han helium Det er et kjemisk element hvis symbol er. Dette er den første edle gassen i det periodiske bordet, og ligger vanligvis på slutten av det samme. Under normale forhold er det en inert gass, siden ingen av de få forbindelsene er stabile; Det utvides også veldig raskt og er stoffet med det minste kokepunkt av alle.
På det populære nivået er det en kjent gass, siden det i utallige arrangementer eller barnefester er vanlig. Imidlertid er det som virkelig er og for alltid tapt mot hjørnene av solsystemet, og utover er de heliumatomer som frigjøres når kloden er brutt ned.
 Ballonger oppblåst med helium, det nærmeste som kan være av dette elementet i hverdagssituasjoner. Kilde: Pixabay.
Ballonger oppblåst med helium, det nærmeste som kan være av dette elementet i hverdagssituasjoner. Kilde: Pixabay. Det er faktisk de som, og med stor grunn, tror at heliumballonger representerer en upassende praksis for denne gassen. Heldigvis har den viktigere og interessante bruksområder, takket være de fysiske og kjemiske egenskapene som skiller den fra andre kjemiske elementer.
For eksempel er flytende helium så kald at det kan fryse hva som helst, som en metalllegering, noe som gjør det til et superledermateriale. Det er også en væske som manifesterer overflødighet, som er i stand til å klatre på veggene i en glassbeholder.
Hans navn skyldes at han først ble identifisert i solen og ikke på jorden. Det er det nest mest tallrike elementet i hele universet, og selv om konsentrasjonen er latterlig i jordskorpen, kan det oppnås fra reservene av naturgass og radioaktive mineraler i uran og thorium.
Her demonstrerer heliumet et annet nysgjerrig faktum: det er en gass som florerer mye mer i undergrunnen enn i atmosfæren, der det ender opp med å rømme fra jorden og dens gravitasjonsfelt.
[TOC]
Historie
Helium ble ikke oppdaget på jorden, men i solen. Faktisk kommer navnet hans fra det greske ordet 'Helios' som betyr sol. Eksistensen av elementet alene kontrasterte den periodiske tabellen til Dmitri Mendeléyev, fordi det ikke var noe sted for en ny gass; Det er, da var det absolutt ingenting om edle gasser.
Navnet 'Helio', skrevet som 'Helium' på engelsk, endte med suffikset -ium som refererte til det som et metall; Nettopp fordi eksistensen av en annen gass bortsett fra oksygen, hydrogen, fluor, klor og nitrogen ikke kunne innrømmes.
Dette navnet ble utpekt av den engelske astronomen Norman Lockyer, som studerte fra England det som ble observert av den franske astronomen.
Det var en gul spektral linje av et ukjent element til da. Lockyer sa at dette skyldtes tilstedeværelsen av et nytt kjemisk element som ble funnet i solen.
I 1895, nesten tjue år senere, anerkjente den skotske kjemikeren Sir William Ramsay det samme spekteret fra en gjenværende gass da han studerte et radioaktivt mineral: Cleveíta. Det var derfor helio her også.
Fysiske og kjemiske egenskaper
Utseende
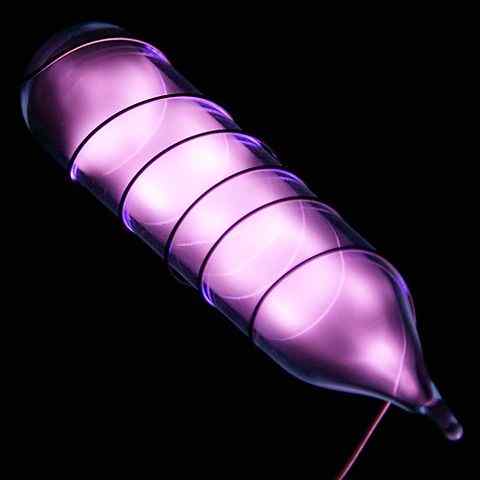 Ampull med en heliumprøve som skinner etter et elektrisk støt. Kilde: Hi-res-bilder av kjemiske elementer [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Ampull med en heliumprøve som skinner etter et elektrisk støt. Kilde: Hi-res-bilder av kjemiske elementer [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Helium er en fargeløs, luktfri gass, som ikke har noen smak og er også inert. Imidlertid, når et elektrisk støt påføres, og avhengig av spenningsforskjellen, begynner det å skinne som en grå-moralsk tåke (øvre bilde), for deretter å skinne med en oransje glød. Derfor er heliumlys oransje.
Atomnummer (z)
2
Molmasse
4,002 g/mol
Smeltepunkt
-272,2 ºC
Kokepunkt
-268,92 ºC
Tetthet
-0.1786 g/l, under normale forhold, det vil si i en gassfase.
-0,145 g/ml, ved smeltepunktet, flytende helium.
-0,125 g/ml, akkurat når helium begynner å koke.
-0,187 g/ml, ved 0 K og 25 atm, det vil si fast helium til de spesifikke trykk- og temperaturforholdene.
Trippelpunkt
2.177 K og 5.043 kPa (0.04935 atm)
Kritisk punkt
5.1953 K og 0.22746 MPa (2.2448 atm)
Fusjonsvarme
0,0138 kJ/mol
Fordampningsvarme
0,0829 kJ/mol
Molar varmekapasitet
20,78 J/(mol · K)
Damptrykk
0,9869 atm ved 4,21 k. Denne verdien tjener til å gi en ide om hvordan flåte.
Ioniseringsenergier
-Først: 2372,3 kJ/mol (han+ gassform)
-For det andre: 5250,5 kJ/mol (han2+ gassform)
Ioniseringsenergier for helium er spesielt høye fordi gassatomet må miste et elektron, som opplever en sterk effektiv kjernefysisk belastning. Det kan også forstås om atomets lille størrelse blir vurdert og hvor "nær" er de to elektronene med hensyn til kjernen (med deres to protoner og to nøytroner).
Løselighet
I vannet blir 0,97 ml oppløst per 100 ml vann ved 0 ºC, noe som betyr at det er lite oppløselig.
Kan tjene deg: ammoniumoksalatReaktivitet
Helium er det nest minst reaktive kjemiske elementet i naturen. Under normale forhold er det vellykket å bekrefte at det er en inert gass; Aldri (for hva det ser ut) kan manipuleres en heliumforbindelse i et rom eller et laboratorium uten store trykk som virker på det; Eller kanskje, dramatisk høye eller lave temperaturer.
Et eksempel vi ser i Na -forbindelsen2Han, som bare er stabil under et trykk på 300 GPa, reprodusert i en diamant yunquecelle.
Mens de kjemiske bindingene i NA2Har "fremmede" for å ha sine elektroner godt lokalisert i krystallene, de er langt fra enkle interaksjoner mellom van der vegger, og derfor består det ikke bare av heliumatomer fanget av molekylære aggregater. Det er her dilemmaet mellom hvilke heliumforbindelser er ekte og som ikke.
For eksempel kan nitrogenmolekyler til høyt trykk fengsle et heliumatom for å forårsake en slags klapp2)elleve.
Dessuten er det endo -underbyggende komplekser av fullerenkationer, c60+n og c70+n, i hvis hulrom de kan huse heliumatomer; og den molekylære kationen heh+ (He-H+), funnet i veldig fjerne tåker.
Oksidasjonsnummer
Hvem av nysgjerrighet prøver å beregne oksidasjonsnummeret for helium i noen av forbindelsene vil finne at dette er lik 0. I NA2Han kunne for eksempel tenkes at formelen hans tilsvarer hypotetiske NA -ioner2+Han2-; Men slikt ville være å anta at han har en ren ionisk karakter, når hans koblinger i virkeligheten langt er fra.
I tillegg vinner ikke helium elektroner fordi det ikke har plass til dem i 2S -orbital, utilgjengelig energi; Og det er heller ikke mulig at du mister dem, på grunn av den reduserte størrelsen på atomet og den store effektive kjernefysiske belastningen på kjernen. Det er grunnen til at helium alltid deltar (i teorien) som et atom0 I sine avledede forbindelser.
Elektronisk struktur og konfigurasjon
Helium, som alle gassene som er observert i en makroescala, opptar volumet av containerne som lagrer den, og har dermed en ubestemt måte. Imidlertid, når temperaturen går ned og begynner å avkjøles under -269 ºC, kondenserer gassen i en fargeløs væske; Helium I, den første av de to flytende fasene for dette elementet.
Årsaken til at helium kondenserer ved en så lav temperatur skyldes de få spredningskreftene som holder atomene sammen; Uansett hvilken fase som ble vurdert. Dette kan forklares fra dens elektroniske konfigurasjon:
1s2
Der to elektroner okkuperer 1s Atomic Orbital. Heliumatom kan visualiseres som en nesten perfekt sfære, hvis homogen elektronisk periferi ikke er veldig utsatt for å polarisere med den effektive kjernefysiske belastningen til de to protonene i kjernen.
Dermed er spontane og induserte dipolmomenter uvanlige og veldig svake; Så temperaturen må nærme seg den absolutte null slik at atomene har nærmet seg tilstrekkelig treghet og få deres spredende krefter til å definere en væske; Eller enda bedre, et heliumglass.
Dimerer
I den gassformige fasen har rommet som skiller atomene slik at det kan antas at en av de andre alltid er atskilt. Så mye at i en blemmer, av lite volum, ser heliet fargeløs ut til det blir utsatt for et elektrisk støt, som ioniserer atomene sine i en gråaktig og liten lys tåke.
Imidlertid har de i væskefasen atomene, selv med sine svake interaksjoner, ikke lenger "ignorere" i lengre tid. Nå tillater spredningskraften dem2. Derfor kan du tenke på Helium I som enorme klynger av han2 i balanse med sine dampfaseatomer.
Det er grunnen til at helium jeg er så vanskelig å skille fra de damper. Hvis denne væsken blir sølt utenfor den hermetiske beholderen, slipper den ut som en hvitaktig bluss.
Helio II
Når temperaturen synker enda mer, berører 2.178 K (-270.972 ºC), oppstår en faseovergang: Helium I blir transformert til Helium II.
Fra dette tidspunktet blir den fascinerende heliumvæsken en overflødig eller kvantevæske; det vil si at dens makroskopiske egenskaper blir manifestert som om dimerer2 De var individuelle atomer (og kanskje de er). Det mangler fullstendig viskositet, fordi det ikke er noen overflate som kan stoppe et atom under glidet eller "klatring".
Det er grunnen til at Helio II kan stige gjennom veggene i en glassbeholder som overvinner tyngdekraften; Uansett hvor høye de er, så lenge overflaten forblir ved samme temperatur og derfor ikke volatiser.
Det kan tjene deg: Hypofysesyre (H3PO2): Egenskaper, bruksområder og reagenserPå grunn av dette kan ikke flytende helium lagres i glassbeholdere, siden den slipper ut før den minste sprekk eller smutthull; Veldig likt hvordan ville det skje med en gass. I stedet brukes rustfritt stål til å designe disse containerne (Dewars Tanks).
Krystaller
Selv om temperaturen gikk ned til 0 k (den absolutte null), ville spredningskraften mellom atomene jeg ikke være sterk nok til å bestille dem i en krystallinsk struktur. For å gjøre størkning, må trykket øke til omtrent 25 atm; Og så vises kompakte sekskantede krystaller (HCP).
Geofysiske studier viser at denne HCP -strukturen forblir uendret uten tvil at trykket økes (opp til rekkefølgen på Pascal Giga, GPA). Imidlertid er det et smalt område i sitt trykk-temperaturdiagram der disse HCP-krystaller lider av en overgang til en kubikkfase sentrert på kroppen (BCC).
Hvor er det og skaffer seg
Kosmos og steiner
 Helium representerer det nest mest tallrike elementet i universet og 24% av massen. Kilde: Pxhere.
Helium representerer det nest mest tallrike elementet i universet og 24% av massen. Kilde: Pxhere. Helium er det nest mest tallrike elementet i hele universet, bare overgått av hydrogen. Stjernene produserer stadig umåtelige mengder heliumatomer ved å fusjonere to hydrogenkjerner under nukleosynteseprosessen.
På samme måte er enhver radioaktiv prosess som avgir α -partikler en kilde til produksjon av heliumatomer hvis de samhandler med miljøelektronene; For eksempel med de av en bergkropp i stridsvogner av radioaktive mineraler av uran og thorium. Disse to elementene lider av radioaktivt forfall, som starter med uran:
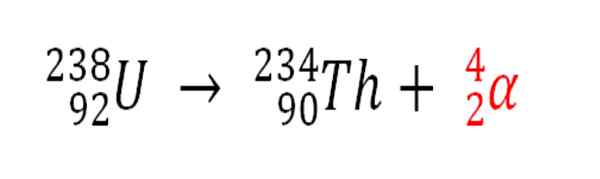 Radioaktivt forfall i uran i dannelsen av ALFAS -partikler, som deretter transformerer til heliumatom i underjordiske avsetninger. Kilde: Gabriel Bolívar.
Radioaktivt forfall i uran i dannelsen av ALFAS -partikler, som deretter transformerer til heliumatom i underjordiske avsetninger. Kilde: Gabriel Bolívar. Derfor, i bergartene der disse radioaktive mineralene er konsentrerte, vil heliumatomer bli fanget, som vil bli frigitt når de er fordøyd i sure medier.
Blant noen av disse mineralene er Cleveíta, Carnotita og uraninitt, alle sammensatt av uranoksider (UO2 eller u3ENTEN8) og urenheter av thorium, tungmetaller og sjeldne jordarter. Helium, vannet gjennom underjordiske kanaler, kan ende opp med å samle seg i naturgassreservoarer, mineralfjærer eller i meteoriske strykejern.
Det anslås at en heliummasse som tilsvarer 3000 tonn produseres årlig, fra det radioaktive forfallet av uran og thorium.
Luft og hav
Helium er ikke veldig løselig i vannet, så før heller enn senere ender det opp med å stige opp fra dypet (der opprinnelsen er funnet), for å krysse lagene i atmosfæren og til slutt nå siderisk rom. Atomene er så små og lette at jordens gravitasjonsfelt ikke kan beholde dem i atmosfæren.
På grunn av det ovennevnte er konsentrasjonen av helium både i luften (5,2 ppm) og i havene (4 ppt) veldig lav.
Hvis du ønsket å hente ut fra noen av disse to mediene, ville alternativet "beste" være luften, som først måtte sende det til flytende for å kondensere alle komponentgassene, mens helium forblir i en gassformig tilstand.
Det er imidlertid ikke praktisk å skaffe helium fra luften, men fra steinene beriket med radioaktive mineraler; Eller enda bedre, av naturgassreserver, der helium kan representere opptil 7% av den totale masse.
Naturgassforsøk og destillasjon
I stedet for å utsette luften, er det enklere og mer lønnsomt. Dermed er råstoffets par excellence (kommersiell) for å oppnå helium naturgass, noe som også kan sendes til brøkdestillasjon.
Destillasjonsproduktet er ferdig med å rense med aktivert karbon, som passerer gjennom et helmurhelium. Og til slutt skiller helium seg fra neon gjennom en kryogen prosess der flytende helium brukes.
Isotoper
Helium presenteres hovedsakelig i naturen som isotopen 4Han, hvis nakne kjerne er den berømte partikkel α. Dette atomet av 4Jeg har to nøytroner og to protoner. I mindre overflod er isotopen 3Han, som bare har ett nøytron. Den første er tyngre (den har en større atommasse) enn den andre.
Dermed isotopparet 3Han og 4Har de som definerer de murable egenskapene og hva vi forstår av helium som et kjemisk element. Siden 3Han er lettere, det antas at atomene deres har mer kinetisk energi, og at de derfor trenger en enda lavere temperatur for å være sammenhengende i en overflødig.
Han 3Jeg har vurdert en veldig sjelden art her på jorden; Imidlertid er det i månejord mer rikelig (ca. 2000 ganger). Det er grunnen til at månen har vært underlagt prosjekter og historier som en mulig kilde til 3Han, som kan brukes som et kjernefysisk drivstoff for fremtidens romfartøy.
Kan tjene deg: rene stofferBlant andre heliumisotoper kan nevnes, med sine respektive halvlivstider: 5Han (t1/2= 7,6 · 10−22 s), 6Han (t1/2= 0,8 s) og 8Han (t1/2= 0.119 s).
Risiko
Helium er en inert gass og deltar derfor ikke i noen av reaksjonene som oppstår i kroppene våre.
Dets atomer kommer praktisk talt inn og blir utpustet uten deres interaksjoner med biomolekyler som gir en påfølgende effekt; Bortsett fra i lyden som sendes ut fra stemmebåndene, som blir mer akutt og har mer frekvens.
Mennesker som inhalerer helio av en ballong (i moderasjon), snakker med en akutt stemme, som ligner på et ekorn (eller and).
Problemet ligger i det faktum at hvis nevnte person inhalerer en upassende mengde helium, risikerer risikoen for kvelende løp, siden atomene deres beveger seg til oksygenmolekyler; Og derfor vil den ikke kunne puste før alt det helium utpusses, noe som igjen på grunn av trykket kan rive lungevevet eller forårsake barotraumas.
Tilfeller av mennesker som har dødd av inhalasjonshelio er rapportert på grunn av det nyutviklede.
På den annen side, selv om det ikke representerer en brannrisiko gitt sin mangel på reaktivitet mot oksygen (eller annet stoff), kan den er fysisk farlig hvis den lagres under høyt trykk og rømming.
applikasjoner
Helios fysiske og kjemiske egenskaper gjør det ikke bare til en spesiell gass, men også et veldig nyttig stoff for anvendelser som fortjener temperaturer i ekstremt lave. I denne delen vil noen av disse applikasjonene eller bruksområdene bli adressert.
Trykk- og rensesystemer
I noen systemer er det nødvendig å øke trykket (trykk), og for dette må det injiseres eller forsyningen som ikke samhandler med noen av komponentene; For eksempel med reagenser eller overflater følsomme for uønskede reaksjoner.
Dermed kan trykket økes med heliumvolum, hvis kjemiske treghet gjør det ideelt for dette formålet. Den inerte atmosfæren som letter overstiger i visse tilfeller av nitrogen.
For omvendt prosess, det vil si rensing, brukes helium også på grunn av dens evne til å dra all oksygen, vanndamp eller annen gass, hvis tilstedeværelse ønsker å eliminere. På denne måten reduseres systemtrykket når heliet er tømt.
Lekkasjeoppdagelse
Helium kan filtreres gjennom den minste sprekk, så det tjener også til å oppdage lekkasjer i rør, høye -vacuumbeholdere eller kryogene tanker.
Noen ganger kan deteksjon gjøres visuelt eller ved berøring; Imidlertid er det meste en detektor som "kaster" signalet om hvor og hvor mye helium slipper unna systemet under inspeksjon.
Dra bensin
Heliumatomer, som nevnt for rensesystemer, kan dra det, avhengig av trykk, tyngre molekyler. For eksempel brukes dette prinsippet daglig i gasskromatografianalyse, siden det kan dra prøven forstøvet langs kolonnen, der den samhandler med den stasjonære fasen.
Ballonger og luftskip
 Helium brukes til å blåse opp luftskipene og er mye tryggere enn hydrogen fordi det ikke er en brennbar gass. Kilde: Pixabay.
Helium brukes til å blåse opp luftskipene og er mye tryggere enn hydrogen fordi det ikke er en brennbar gass. Kilde: Pixabay. På grunn av den lave tettheten sammenlignet med luft og igjen, med dens mangel på reaktivitet med oksygen, har den blitt brukt til å blåse opp ballonger på barnefester (blandet med oksygen slik at ingen blir kvalt for å puste) og luftskip (overlegen bilde) , uten å kunne representere en risiko for brann.
Stupe
 Helium er en av hovedkomponentene i oksygentankene som dykkerne puster. Kilde: Pxhere.
Helium er en av hovedkomponentene i oksygentankene som dykkerne puster. Kilde: Pxhere. Når dykkerne går ned til større dybder, synes de det er vanskelig å puste som et resultat av det store trykket som utøves av vannet. Det er grunnen til.
Buesveising
I sveiseprosessen bringer den elektriske buen nok varme slik at de to metallene blir sammenføyd. Hvis det utføres under en atmosfære av helium, vil det glødende metallet ikke reagere med oksygenet i luften for å bli dets respektive oksid; Derfor forhindrer helium at dette skjer.
Superledere
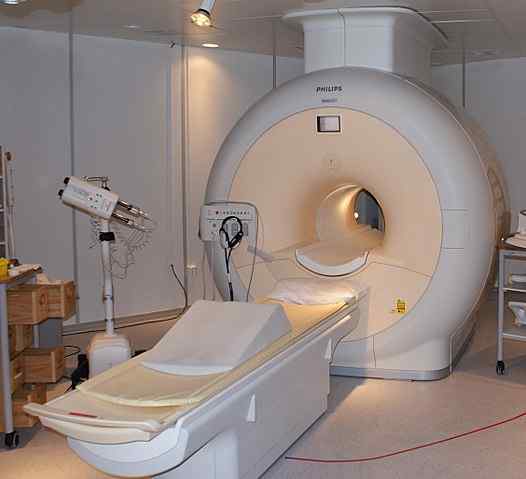 Flytende helium brukes til å kjøle magnetene som brukes i skannerne av kjernefysisk resonansavbildning. Kilde: Jan Ainali [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Flytende helium brukes til å kjøle magnetene som brukes i skannerne av kjernefysisk resonansavbildning. Kilde: Jan Ainali [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Flytende helium er så kald at det kan fryse metaller for å forvandle dem til superledere. Takket være dette er det produsert veldig kraftige magneter, som, nedkjølt med flytende helium, har blitt brukt i bilder av bilder eller spektrometre av kjernefysisk magnetisk resonans.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Andy Estance. (17. april 2019). Heliumhydridion oppdaget i verdensrommet for første gang: bevis som ble funnet for unnvikende kjemi fra universets første minutter. Gjenopprettet fra: Chemistryworld.com
- Peter Wothers. (19. august 2009). Helium. Kjemi i elementet. Gjenopprettet fra: Chemistryworld.com
- Wikipedia. (2019). Helium. Hentet fra: i.Wikipedia.org
- Mao, h. K., Wu, og., Jephcoat, a. P., Hemley, r. J., Bell, s. M., & Bassett, w. TIL. (1988). Krystallstruktur og tetthet av helium opp til 232 kbar. Hentet fra: Artikler.Adsabs.Harvard.Edu
- Nasjonalt senter for bioteknologiinformasjon. (2019). Helium. PubChem -database. CID = 23987. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Mary-Ann Muffoletto. (6. februar 2017). Opp, opp og bort: kjemikere sier 'ja,' helium kan danne forbindelser. Utah State University. Gjenopprettet fra: Phys.org
- Steve Gagnon. (s.F.). Isotoper av elementet helium. Jefferson Lab. Gjenopprettet fra: Utdanning.Jlab.org
- Advameg, inc. (2019). Helium. Gjenopprettet fra: ChemistryExplaed.com

