Hemoolisinegenskaper, typer, virkningsmekanismer
- 5045
- 1572
- Thomas Karlsen
De Hemoolis Det er et lite protein som forårsaker porer i cellemembranen til erytrocytter og noen andre celler av pattedyrs blod. Det syntetiseres generelt og skilles ut av patogene bakterier.
Dette proteinet er et av de vanligste mikrobielle giftstoffene og det som best har blitt studert. Noen ganger kan det forårsake hemolytisk anemi, siden mengden kanaler som celleinteriøret kommer ut, til og med kan forårsake cellelysering.
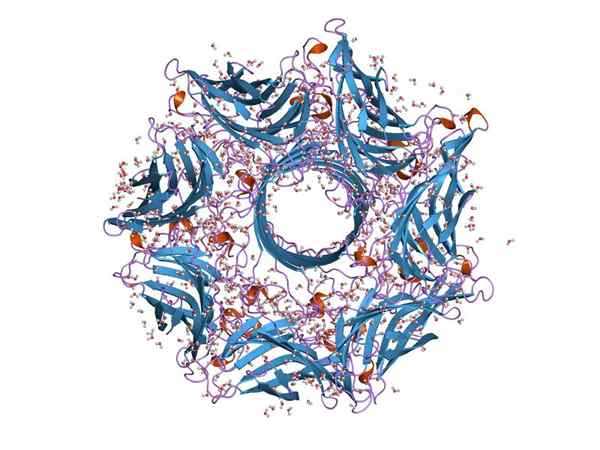
 Molekylær struktur av en hemoolis (kilde: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Molekylær struktur av en hemoolis (kilde: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Generelt er hemoolisin et typisk toksin av arten av Streptococcus av tarmkanalen. Funksjonen gjør det mulig.
Den vanligste måten hemoolis finnes i naturen er i sin α-hemoliseringsform. Dette proteinet er en av de viktigste virulensfaktorene av de fleste stammer av Escherichia coli og noen Closrides.
De fleste urinveisinfeksjoner er forårsaket av stammer av Escherichia coli som produserer a-hemolisin med hemolytiske egenskaper.
Hemoolisin og bakteriocinproduksjon har vært relatert til bakteriestammer med en kompetansemekanisme mot andre arter, og produksjonen av begge giftstoffene ser ut til å avhenge av de samme genetiske determinantene i bakteriens genom.
[TOC]
Kjennetegn
Hemoolisin utgjøres av syv underenheter og genet som koder for at det har syv promotorer. Disse syv underenhetene settes inn i plasmamembranen til de hvite cellene, og når de er sammen, danner de en ionisk kanal der metabolittene til celleinteriøret rømmer.
Hemoolisin er kalsium -avhengig cytotoksin (Ca+2) ekstracellulær som virker på plasmamembranen til blodstrømceller. Porene som skaper i membranen er også hydrofile og forårsaker inntreden av vann i celleinteriøret, noe som kan forårsake lysis.
Det kan tjene deg: Unaporto: Transport gjennom membraner, egenskaperHemoolisiner er proteinprodukter som er typiske for bakterier av gram-negativ type, og alle deler to egenskaper:
1- Tilstedeværelsen av et veldig lite peptid (ikke-apéptid) dannet av gjentatt glycin og asparaginsyre. Hemoolisin ikke-kapapéptider er lokalisert i nærheten av den C-terminale delen av den primære proteinstrukturen.
2- Alle hemoolisiner skilles ut av bakterien til det ekstracellulære mediet gjennom en ABC-type transportør (fra den engelske ATP-bindende kassetten).
Hemoolisiner blir vanligvis påvist i bakteriestammer gjennom vekst midt i blodagar. I testen observeres en hemolytisk glorie, produkt av brudd på de røde blodlegemene nær bakteriekoloniene.
Folkens
Det er flere forskjellige typer hemoolisiner, disse er klassifisert med et gresk brev i begynnelsen av navnet sitt. De mest studerte og vanlige er α, β og y hemoolisiner, alle produsert av stamme Staphylococcus aureus.
Hemoolisin -typer er klassifisert i henhold til rekke celler som angriper og i henhold til deres primære proteinstruktur.
α-hemolisin
Dette proteinet er typisk for stammene av Staphylococcus aureus og Escherichia coli; angriper nøytrofiler, røde blodlegemer, lymfocytter, makrofager, voksne og embryonale fibroblaster. Samhandle med de polare hodene til plasmamembranlipidene i disse cellene til de internaliserer en hydrofob hale på omtrent 5 ӑ inne i membranen.
β-hemolisin
Produsert av Staphylococcus aureus Til en mindre andel enn a-hemolisin angriper ß-hemolisin hovedsakelig erytrocytter og er internt i membranen utelukkende gjennom rike domener i sfingomyeline av cellemembranen.
y-hemolisin
Det er også blitt observert i Staphylococcus aureus. Det har blitt klassifisert som et hemolytisk protein og leukotoksin samtidig, siden det påvirker polymorfonukleære celler av mennesker, monocytter, makrofager og sjelden, selv til de røde blodlegemene.
Denne typen y-hemolisering er en av de minst karakteriserte, derfor har mye av virkningsmekanismen vært ukjent, og dette er ikke undersøkt In vivo.
Kan tjene deg: Osteoblaster: trening, egenskaper, funksjoner, patologierHandlingsmekanismer
Handlingsmekanismen som er avklart relativt klar er α-hemoliserin. Siden alle er hemolytiske proteiner, antas det imidlertid at de fleste prosesser er vanlige for alle hemolysiner.
Forskere antyder at de for bakterier de segregerer hemoolis i miljøet de må være i et næringsstoff -operativt mikro -miljø, derfor vil dette være en mekanisme som utløser cellen til å ødelegge hvite celler og oppnå næringsstoffene sine.
Mekanismen er beskrevet i tre trinn: Unionen til cellemembranen, innsetting og oligomerisering.
Membranforening
Det har blitt funnet at hemoolisiner kan bli sammen med integrinene til nøytrofiler og i erytrocytter er det blitt observert at disse proteinene binder seg til glykosylerte komponenter som glykoproteiner, gangliasider og cellemembrangllyphoriner.
Noen forfattere antyder at tilstedeværelsen av reseptorer i membranen ikke er essensiell for at foreningen av hemolysiner skal oppstå. I alle fall er mekanismen for å gjenvise cellulært protein ennå ikke kjent nøyaktig.
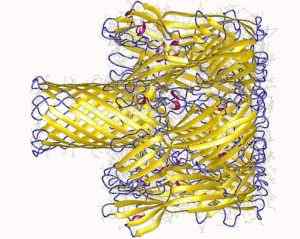 Transmembranal pore dannet av Staphylococcus hemoolisinprotein (kilde: avsetningsforfattere: sang, l., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.OG.; Visualiseringsforfatter: Bruker: Astrojan [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] via Wikimedia Commons)
Transmembranal pore dannet av Staphylococcus hemoolisinprotein (kilde: avsetningsforfattere: sang, l., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.OG.; Visualiseringsforfatter: Bruker: Astrojan [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] via Wikimedia Commons) Interaksjonen med membranen skjer i to trinn:
- Innledende union (reversibel): Når hemoolisbinder seg til membranens kalsiumkryssdomener. Dette trinnet oppstår på overflaten og er veldig utsatt for elektrostatisk utslipp.
- Irreversibel forening: Bestill aminosyredomenene med lipidkomponentene i det ytre laget av plasmamembranen til de hvite cellene, for å danne fysiske fagforeninger mellom de hydrofobe forbindelsene i membranen.
Kan tjene deg: celleveggInnføring av toksin i membranen
Α-hemolisin setter inn avfall 177 og 411 i det første lipidmonolaget. I det ekstracellulære mediet er hemoolisin assosiert med kalsiumioner, noe som induserer en strukturell arrangement i dette og bidrar til aktivering av den.
Denne innsatsen konsoliderer den irreversible foreningen til cellemembranen. Når arrangementet har skjedd, blir hemoolisin et integrert protein, siden det eksperimentelt sett har vist seg at den eneste måten å trekke det ut fra membranen er gjennom bruk av vaskemidler som Triton X-100.
Oligomerisering
Når all hemoolis har blitt satt inn i plasmamembranen til den hvite cellen.
Det er observert at oligomeriseringsprosessen er foretrukket av mikrodominier eller lipidbalsas i cellemembranen. Disse regionene favoriserer kanskje ikke foreningen av proteinet, men de favoriserer oligomeriseringen av det når det først er satt inn.
Jo mer hemoolisiner binder seg til membranen, jo større blir mengden porer dannet. Dessuten kan hemoolisiner oligomerisere med hverandre (tilstøtende) og danne mye større kanaler.
Referanser
- Bakás, l., Ostolaza, h., Vaz, w. L., & Goñi, f. M. (nitten nittiseks). Reversibel adsorpsjon og ikke-reversibel innsetting av Escherichia coli alfa-hemolysin i lipid-dobbeltlag. Biophysical Journal, 71 (4), 1869-1876.
- Dalla Serra, m., Coraiola, m., Viero, g., Comai, m., Potrich, c., Ferreras, m.,... & prévot, g. (2005). Staphylococcus aureus bicomponent y-hemolysiner, HLGA, HLGB og HLGC kan blandet for å telle alle komponenter. Journal of Chemical Information and Modelling, 45 (6), 1539-1545.
- GOW, J. TIL., & Robinson, J. (1969). Egenskaper for renset stafylokokk β-hemolysin. Journal of Bacteriology, 97 (3), 1026-1032.
- Ike, og., Hashimoto, h., & Clewell, D. B. (1984). Hemolysin av Streptococcus faecalis subpecies zymogenes du bidrar til virulens hos mus. Infeksjon og immunitet, 45 (2), 528-530.
- Remington, J. S., Klein, J. ENTEN., Wilson, ca. B., Nizet, v., & Maldonado, og. TIL. (Eds.). (1976). Smittsomme ørkener av fosteret og nyfødt spedbarn (Vol. 4). Philadelphia: Saunders.
- Todd, e. W. (1932). Antigent streptokokk hemolysin. Journal of Experimental Medicine, 55 (2), 267-280.
- « Pietrain opprinnelse, egenskaper, mat, reproduksjon
- Connivating Valves Egenskaper, histologi, funksjoner »

