Alifatiske hydrokarbonegenskaper, nomenklatur, reaksjoner, typer

- 1720
- 386
- Marius Aasen
De Alifatiske hydrokarboner De er alle de som mangler aromatisitet, ikke i luktende forstand, men med hensyn til kjemisk stabilitet. Å klassifisere hydrokarboner på denne måten er i dag for tvetydig og upresis, siden det ikke skiller mellom forskjellige typer hydrokarboner som ikke er aromatiske.
Dermed har vi alifatiske hydrokarboner og aromatiske hydrokarboner. Sistnevnte gjenkjennes av deres grunnleggende enhet: Benncénico -ringen. De andre, derimot, kan ta i bruk enhver molekylstruktur: lineær, forgrenet, syklisk, umettet, polysyklisk; Så lenge de ikke har konjugerte systemer som benzen.
 Lynets flytende drivstoff består av en blanding av alifatiske hydrokarboner. Kilde: Pixnio.
Lynets flytende drivstoff består av en blanding av alifatiske hydrokarboner. Kilde: Pixnio. Begrepet 'alifatisk' ble født fra det greske ordet 'Aleiphar', som betyr fett, også brukt til å referere til oljer. Derfor ble denne klassifiseringen på det nittende århundre tildelt hydrokarbonene oppnådd fra de fete ekstraktene; Mens aromatiske hydrokarboner ble trukket ut fra tre- og velduftende harpikser.
Som grunnlaget for organisk kjemi konsolidert, ble det imidlertid oppdaget at det var en kjemisk egenskap som differensierte hydrokarboner, enda viktigere enn deres naturlige kilder: aromatisitet (og ikke duft).
På denne måten opphørte alifatiske hydrokarboner bare de som er oppnådd fra fett, for å være alle de som mangler aromatisitet. Innenfor denne familien har vi alkener og alkyner, uavhengig av om de er lineære eller sykliske. Det er grunnen til at 'alifatisk' anses som unøyaktig; Selv om det er nyttig for å adressere noen generelle aspekter.
For eksempel, når det sies 'ekstreme' eller 'kjeder' alifatiske, blir molekylære regioner henvist til der aromatiske ringer er fraværende. Av alle alifatiske hydrokarboner er den enkleste per definisjon metan, Cho4; Mens benzen er den enkleste av aromatiske hydrokarboner.
[TOC]
Egenskaper til alifatiske hydrokarboner
Egenskapene til alifatiske hydrokarboner svinger i forskjellige grader avhengig av hvilke som blir vurdert. Det er lave og høye molekylære masser, så vel som lineære, forgrenede, sykliske eller polysykliske, selv de av fantastiske tre -dimensjonale strukturer; Som med kubanen, i form av en kube.
Imidlertid er det noen generaliteter som kan nevnes. De fleste alifatiske hydrokarboner er hydrofobe og apolare gasser eller væsker, og har noen mer apolar enn andre, siden selv de som har karbonkjeder har halogen, oksygen, nitrogen eller svovelatomer er inkludert i listen.
Kan tjene deg: bor: historie, egenskaper, struktur, brukDe er også brennbare forbindelser, siden de er mottakelige for oksiderende i luften før en minimum varmekilde. Denne funksjonen blir farligere hvis vi legger til den høye volatiliteten, på grunn av de svake spredende interaksjonene som opprettholder alifatiske molekyler sammenhengende.
For eksempel ser vi det i butanen, en gass som kan være flytende med relativt letthet så vel som propan. Begge er veldig ustabile og brennbare, så de er aktive komponenter av kjøkkengass eller lommelysere.
En slik volatilitet har selvfølgelig en tendens til å avta ettersom molekylmassen og hydrokarbon forårsaker flere og mer tyktflytende væsker.
Nomenklatur
Nomenklaturen til hydrokarboner skiller seg enda mer enn dens egenskaper. Hvis de er alko eller alkiner, følges de samme standardene som er fastsatt av IUPAC: Velg den lengste kjeden, og tilordne de laveste indikatorene til den mest erstattede enden eller til heteroatomene eller mer reaktive grupper.
På denne måten vet du i hvilket karbon hver substituent finnes, eller til og med umettethet (doble eller trippelkoblinger). Når det.
Tenk for eksempel på følgende to sykloheksaner:
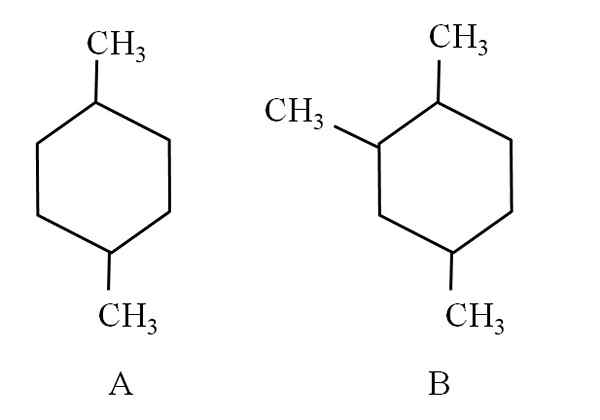 To sykloheksaner, som er klassifisert som alifatiske hydrokarboner. Kilde: Gabriel Bolívar.
To sykloheksaner, som er klassifisert som alifatiske hydrokarboner. Kilde: Gabriel Bolívar. Cyclohexan A, kalles 1,4-dimetylciclohexan. Hvis ringen var fem karbonatomer, ville det være 1,4-dimetylciclopentano. I mellomtiden kalles Cyclohexan B 1,2,4-trimetylcykloheksan, og ikke 1,4,6-cykloheksan, da den søker å bruke de laveste indikatorene.
Nå kan nomenklaturen bli veldig komplisert for operabotiske strukturer hydrokarboner. For dem er det mer spesifikke regler, som må forklares separat og nøye; Som med målene, terpenene, retningslinjene og de polysykliske forbindelsene.
Reaksjoner
Forbrenning
Heldigvis er reaksjonene mindre varierte for disse hydrokarbonene. En av dem ble allerede nevnt: de forbrenninger lett, og produserte karbondioksid og vann, i tillegg til andre oksider eller gasser avhengig av tilstedeværelsen av heteroatomer (Cl, N, P, O, etc.). Imidlertid CO2 og h2Eller er de viktigste forbrenningsproduktene.
Addisjon
Hvis de har umettethet, kan de lide tilleggsreaksjoner; Det vil si at de inneholder små molekyler i skjelettet som substituenter etter en spesifikk mekanisme. Blant disse molekylene har vi vann, hydrogen og halogener (f2, Cl2, Br2 og jeg2).
Halogenering
På den annen side, alifatiske hydrokarboner under forekomst av ultrafiolett stråling (Hv) og varme kan bryte C-H-koblinger for å endre dem ved C-X-koblinger (C-F, C-CL, etc.). Dette er halogeneringsreaksjonen, som observeres i veldig kortkjede -alkaner, for eksempel metan eller pentan.
Kan tjene deg: nitritter: egenskaper, struktur, nomenklatur, formasjonCraqueo
En annen reaksjon på at alifatiske hydrokarboner kan lide, spesielt langkjede alkaner, er termisk sprekker. Den består av tilførsel av intens varme slik at den termiske energien bryter C-C-bindingene, og dermed dannes små molekyler, mer sitert i drivstoffmarkedet, fra store molekyler dannes.
De fire reaksjonene ovenfor er de viktigste som kan lide et alifatisk hydrokarbon, og forbrenningen er den viktigste av alle, da det ikke diskriminerer noen forbindelse; Alle vil brenne i nærvær av oksygen, men ikke alle vil legge til molekyler eller bryte seg inn i små molekyler.
Folkens
Alifatiske hydrokarboner grupperer uendelige forbindelser, som igjen er klassifisert mer spesifikke, noe.
I følge hvor umettede de er, har vi alkaner (mettede), alkener og alkyner (umettet).
Alkanene er preget av å ha enkle C-C-koblinger, mens vi i alkener og alkiner observerer lenker C = C og C≡C, henholdsvis. En veldig generell måte å visualisere dem på er å tenke på karbonskjelettene i alkaner som sikksagen og brettede kjeder, være "firkantet" for alkener, og "rette linjer" for alkiner.
Dette er fordi de doble og trippelbindinger har energi og stenrisk begrensning i rotasjonene sine, "herding" strukturene sine.
Alkitos og alkiner kan være forgrenet, syklisk eller polysyklisk. Det er grunnen til.
Fra alkener oppstår andre typer hydrokarboner, for eksempel målene (med to dobbeltbindinger), polienøs (med mange doble alternative bindinger) og terpener (forbindelser avledet fra isopren, en dien).
applikasjoner
Igjen, bruk for disse hydrokarbonene kan variere avhengig av hvilken som blir vurdert. Imidlertid, i delene av egenskaper og reaksjoner, ble det klart at all forbrenning, ikke bare for å frigjøre gassmolekyler, men også lys og varme. Dermed er de energireservoarer, nyttige å tjene som drivstoff eller varmekilder.
Det er grunnen til at de brukes som en del av sammensetningen av bensin, for naturgass, i Bunsen -lightere, og generelt for å kunne stamme brann.
Kan tjene deg: oktettregelEt av de mest bemerkelsesverdige eksemplene er at acetylen, HC≡CH, hvis forbrenning gjør det mulig å begeistre metallionene til en prøve i atomabsorpsjonsspektrometri utført på analytiske tester. På samme måte kan den resulterende brannen brukes til sveiser.
Flytende alifatiske hydrokarboner, for eksempel parafinikk, brukes ofte som fettekstraksjonsoppløsningsmidler. I tillegg kan dens løsningsmiddelvirkning brukes til å fjerne flekker, emaljer, malerier eller bare for å fremstille løsninger av en spesifikk organisk forbindelse.
Den største molekylmassen, som allerede er tyktflytende eller fast, er bestemt til utdyping av harpikser, polymerer eller medisiner.
Når det gjelder begrepet 'alifatisk', brukes det vanligvis til å referere til disse regionene, i et makromolekyl, som mangler aromatisk. For eksempel beskrives asfalter overfladisk som en aromatisk kjerne med alifatiske kjeder.
Eksempler
Først ble det sagt at metan er den enkleste av alifatiske hydrokarboner. De blir fulgt av propan, Cho3Ch2Ch3, Butano, kap3Ch2Ch2Ch3, Pentano, kap3Ch2Ch2Ch2Ch3, Octane, Nonano, Dean og så videre, å ha stadig lange alkaner.
Det samme gjelder etylen, Cho2= Ch2, Propeno, kap3CH = CH2, Buteno, kap3Ch2CH = CH3, Og for resten av alkinene. Hvis det er to dobbeltbindinger, er de oley, og hvis det er mer enn to, polienaer. På samme måte kan det være doble og trippelkoblinger i samme skjelett, noe som øker strukturell kompleksitet.
Blant cykloalcanos kan vi nevne cyclopropan, cyclobutane, cyclopentano, cyclohexan, cycloheptano, cyclooctane, samt cyclohexen og cyclohexin. Fra alle disse hydrokarbonene oppnås forgrenede derivater, noe som ytterligere multipliserer tilgjengelige eksempler (for eksempel 1,4-dimetylciclohexano).
Av de mest representative terpenene har vi limonen, mentol, pinene, vitamin A, escualeno, etc. Polyetylen er en mettet polymer med enheter -CH2-Ch2-, Så det er også et eksempel på disse hydrokarbonene. Andre eksempler er allerede sitert i de forrige seksjonene.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (22. august 2019). Alifatisk hydrokarbondefinisjon. Gjenopprettet fra: Thoughtco.com
- Wikipedia. (2019). Alifatisk forbindelse. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. (20. august 2019). Alifatiske hydrokarboner. Gjenopprettet fra: Chem.Librettexts.org
- Elizabeth Wyman. (2019). Alifatiske hydrokarboner: Definisjon og egenskaper. Studere. Gjenopprettet fra: Studie.com

