Hydrolasasestruktur, funksjoner, eksempler

- 644
- 17
- Daniel Skuterud
De Hydrolase De er enzymer som er ansvarlige for å hydrolysere forskjellige typer kjemiske koblinger i mange forskjellige forbindelser. Blant hovedkoblingene som hydrolyz er ester-, glukosidiske og peptidlenker.
Innenfor gruppen av hydrolaser er mer enn 200 forskjellige enzymer klassifisert, gruppert minst 13 individuelle sett; Klassifiseringen er i hovedsak basert på typen kjemisk forbindelse som fungerer som et underlag.
 Grafisk modellering med bioinformatikkverktøy for strukturen til en hydrolase (kilde: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons)
Grafisk modellering med bioinformatikkverktøy for strukturen til en hydrolase (kilde: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) Hydrolaser er uunnværlige for fordøyelse av mat i tarmen av dyr, siden de er ansvarlige for å nedbryte en stor del av koblingene som utgjør de karbonatiserte strukturene i maten som de inntar.
Disse enzymene fungerer i vandige medier, siden de trenger vannmolekyler rundt seg for å tilføre forbindelsene når molekylene er delt. Med enkle ord utfører hydrolaser en hydrolytisk katalyse av forbindelsene de virker.
For eksempel, når en hydrolase bryter en C-C kovalent binding, er resultatet vanligvis en C-O-gruppe og en C-H-gruppe.
[TOC]
Struktur
Som mange enzymer er hydrolaser organiserte kuleproteiner i komplekse strukturer som er organisert gjennom intramolekylære interaksjoner.
Hydrolaser, som alle enzymer, binder seg til ett eller flere underlagsmolekyler i et område av dens struktur som er kjent som "aktivt sted". Dette stedet er en lomme eller kløft omgitt av mange aminosyrerester som letter grepet eller foreningen av underlaget.
Hver type hydrolase er spesifikk for et gitt underlag, som bestemmes av dens tertiære struktur og ved dannelse av aminosyrer som gjør sitt aktive sted. Denne spesifisiteten ble hevet didaktisk av Emil Fischer som en slags "nøkkel og lås".
Kan tjene deg: Polymerase: Karakteristikker, struktur og funksjonerFor tiden er det kjent at underlaget generelt induserer endringer eller forvrengninger i dannelsen av enzymer og at enzymer på sin side forvrenger strukturen til underlaget for å sikre at dette "blonder" på sitt aktive sted.
Funksjoner
Alle hydrolaser har hovedfunksjonen for å bryte kjemiske bindinger mellom to forbindelser eller innenfor strukturen til det samme molekylet.
Det er hydrolaser for å bryte nesten alle typer koblinger: noen nedbryter esterbindinger mellom karbohydrater, andre peptidbindinger mellom proteinaminosyrer, andre karboksylbindinger, etc.
Hensikten med den kjemiske bindingsprosessen katalysert av et hydrolase -enzym varierer betydelig. Smozyme er for eksempel ansvarlig for hydrolyse av kjemiske bindinger med organismebeskyttelsesformål som syntetiserer det.
Dette enzymet nedbryter koblingene som holder sammen med forbindelsene i celleveggen til bakteriene, med sikte på å beskytte menneskekroppen mot bakteriell spredning og en mulig infeksjon.
Nucleas er "fosfatase" -enzymer som har evnen til å nedbryte nukleinsyrer, som også kan representere en celleforsvarsmekanisme mot DNA- eller RNA -virus.
Andre hydrolaser, som for eksempel typen "proteaser", ødelegger peptidbindingene av proteiner i fordøyelseskanalen for å gjøre aminosyrer assimileres i mage -tarmpitel.
Selv hydrolaser er involvert i forskjellige energiproduksjonshendelser i cellemetabolisme, siden fosfataser katalyserer frigjøring av fosfatmolekyler fra høy -energisubstrater som pyruvat, i glykolyse.
Det kan tjene deg: Soyabønne grepEksempler på hydrolasaser
Blant det store mangfoldet av hydrolaser som forskere har identifisert, har noen blitt studert med større vekt enn andre, siden de er involvert i mange viktige prosesser for celleliv.
Blant disse er glattheten, proteasen serin, endonukleous og glukosidase eller glykosyraeous fosfataser.
Glattheten
Enzymer av denne typen går i stykker. Dette ender vanligvis opp med å forårsake en total lysis av bakteriene.
Smozymer forsvarer kroppen til dyr av bakterieinfeksjoner og er rikelig i kroppssekretninger i vev som er i kontakt med miljøet, for eksempel tårer, spytt og slim.
Det glatte kyllingegget var den første proteinstrukturen som krystalliserte gjennom X -RAYS. Denne krystalliseringen ble laget av David Phillips, i 1965, på London Real Institute.
Det aktive stedet for dette enzymet er sammensatt av asparagin-alanin-mekanin-peasparagin-glycin-glycin-peragin-plain-metionin-peptid (NAM-NAG-NAM).
Protease Serin
Enzymene i denne gruppen er ansvarlige for hydrolyserende peptidbindinger i peptider og proteiner. De mest studerte er Trpsin og Chimotripsin; Imidlertid er det mange forskjellige typer proteaser, som varierer med hensyn til spesifisiteten til underlaget og dets katalysemekanisme.
"Proteasene" er preget av å ha en nukleofil serin -type nukleofil aminosyre. Proteasas Serin er også i stand til å bryte et bredt utvalg av esterkoblinger.
Kan tjene deg: Hva er den kjemiske sammensetningen av levende vesener?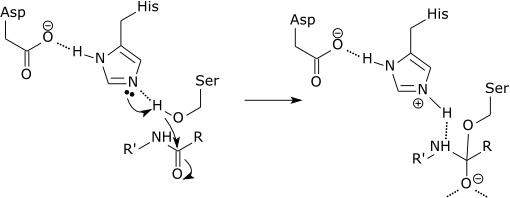 Grafisk skjema for virkningen av en protease som bryter en peptidkobling i histidinaminosyren (kilde: Zephyris at det engelske språket Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/)] via Wikimedia Commons)
Grafisk skjema for virkningen av en protease som bryter en peptidkobling i histidinaminosyren (kilde: Zephyris at det engelske språket Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/)] via Wikimedia Commons) Disse enzymene kutter peptider og proteiner på en ikke -spesifikk måte. Imidlertid må alle peptider og proteiner som skal kutt.
Hver korte protease er nøyaktig AMIDA-bindingen som dannes mellom den C-terminale enden av aminosyren i karboksylenden og aminesyreaminet som er mot den N-terminale enden av peptidet.
Nukleasefosfataser
Disse enzymene katalog. Det er mange forskjellige typer av disse enzymene, siden de er spesifikke for typen nukleinsyre og skjærested.
 Grafisk skjema for virkningen av en endonuklease som hydrolyserer en fosfodiésterbinding (kilde: J3D3 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Grafisk skjema for virkningen av en endonuklease som hydrolyserer en fosfodiésterbinding (kilde: J3D3 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) Endonukleaser er uunnværlige innen bioteknologi, siden de lar forskere endre genomene til organismer ved å kutte og erstatte fragmenter av den genetiske informasjonen til nesten hvilken som helst celle.
Endonukleasene gjør skjæring av nitrogenholdige baser i tre trinn. Den første er gjennom en nukleofil aminosyre, deretter dannes en mellomstruktur med negativ belastning som tiltrekker fosfatgruppen og til slutt bryter koblingen mellom de to basene.
Referanser
- Davies, g., & Henrissat, B. (nitten nitti fem). Strukturer og mekanismer for glykosylhydrolas. Struktur, 3 (9), 853-859.
- Lehninger, a. L., Nelson, d. L., Cox, m. M., & Cox, m. M. (2005). Lehninger prinsipper for biokjemi. Macmillan.
- Mathews, a. P. (1936). Prinsipper for biokjemi. W. Tre.
- Murray, r. K., Granner, d. K., Mayes, s., & Rodwell, V. (2009). Harpers illustrerte biokjemi. 28 (s. 588). New York: McGraw-Hill.
- Ollis, d. L., Cheeah, e., Cygler, m., Dijkstra, f., Folow, f., Franken, s. M.,… & Sussman, J. L. (1992). Α/β hydrolase -folden. Ingeniørprotein, design og seleksjon, 5 (3), 197-211.

