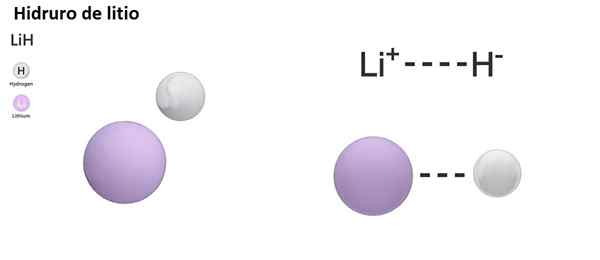Hydror
- 4410
- 201
- Mathias Aas
Hva er hydrus?
Hydros er kjemiske forbindelser som er resultatet av reaksjon av hydrogen med metallelementer (natrium, kalium, kalsium, etc.) og ikke metaller (klor, fluor, oksygen, nitrogen, karbon, etc.). Hydrogen reagerer med nesten alle kjemiske elementer, så hydror er veldig forskjellige stoffer.
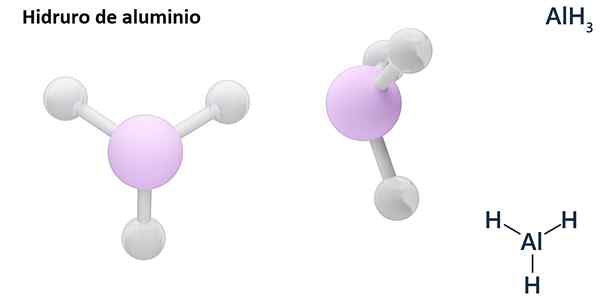
Dens generelle formler kan være MH -typenn, Hvor m er metall og n dets Valencia (+1, +2, +3), som aluminiumhydrid, ALH3; eller av EH -typenn eller hnOg der e er et ikke -metallisk element og n Det er Valencia, som NH3 eller h2S.
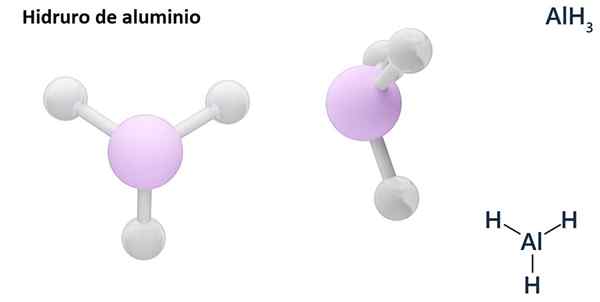
Hydros er vanligvis binære forbindelser, det vil si at de er resultatet av kombinasjonen av hydrogen med et annet kjemisk element. Imidlertid kan hydrogen også etablere kombinasjoner med flere kjemiske elementer, for å danne mer komplekse hydror. Alle hydrorene som er forklart vil være binære, for eksempel ALH3 og nah.
Det er tre typer hydror i henhold til arten av den kjemiske bindingen: ionisk, molekylær og metallisk. Ioniske eller saltvannshydror er preget av tilstedeværelsen av en ionisk binding. Denne koblingen består av den elektriske attraksjonen mellom den positive belastningen til et alkalisk metall (NA+) eller alkalisk-bunt (mg2+), og den negative belastningen av hydridanion (h-).
Molekylære hydrider er derimot preget av dannelsen av en kovalent binding mellom hydrogen og et ikke -metallisk element. Blant de ikke -metalliske elementene som danner hydros er: klor, brom, fluor, jod, oksygen og nitrogen.
Og metallhydror skyldes kombinasjonen av hydrogen med noen overgangsmetaller. Denne typen hydrider, i motsetning til de tidligere, har komplekse strukturer og vil ikke bli forklart her.
Hydrosegenskaper
Egenskapene til hydrover varierer avhengig av typen hydrid: ionisk, molekylær eller metallisk, så deres egenskaper må angis separat.
Ioniske eller saltvannshydror
De er krystallinske hvite faste stoffer, men på grunn av tilstedeværelsen av urenheter får de en gråaktig farge. Disse hydridene er ikke oppløselige i vanlige løsningsmidler, for eksempel vann, alkohol, etc. De har også høye koke- og fusjonspunkter.
De har en høy og smeltet tilstandstetthet kan utføre strøm.
Ioniske hydurner anses som grunnleggende eller alkalisk, siden det ble oppløst i vann danner hydroksider og frigjør molekylært hydrogen:
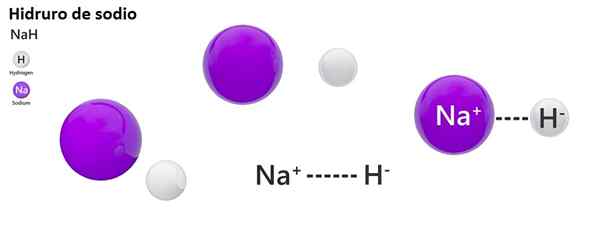
Nah +h2O → h2 + Naoh
Reaksjonen av det ioniske hydridet med vann er veldig kraftig og farlig: det produserer hydrogen i en gassform, som er et brennbart og brennbart materiale.
Ioniske hydurns kan også reagere med metallhalogenider, dannet av et metall og en ikke -metall kjent som halogen (MX, X = F, Cl, BR, I):
Kan tjene deg: dimetylanylin: struktur, egenskaper, syntese, bruk4 Lih +Alcl3 → Lialh4 + 3 Licl
LiH (litiumhydrid) er en binær forbindelse; Mens Lialh4 (Litium og aluminiumhydrid) er en ternær forbindelse, det vil si at den består av tre kjemiske elementer.
Molekylære eller kovalente hydros
De er i flytende eller gassformig tilstand i motsetning til ioniske hydror. De har lave koke- og fusjonspunkter, og observerer at ved å øke molekylvekten til hydrid, øker kokepunktet; Bortsett fra ammoniakk (NH3), Vann (h2O) og fluorhydrid (HF).
Kovalente hydrider er dårlige strømledere, og mange av deres egenskaper skyldes dannelsen av hydrogenbroer. Kovalente hydrider anses som syrer, siden det oppløst i vann kan forårsake syrer, for eksempel saltsyre.
Metallhydror
De er i solid tilstand og presenterer den mørke tonen av metaller. De er gode strømledere og har skinnende overflater. Metalliske hydrider som er stabile i luften blir reagenser når de varmer opp, for eksempel uranhydrid (UH3) Presentere denne eiendommen.
Nomenklatur
Måten å navngi Hydrors er enkel, og varierer ikke for mye i noen av nomenklaturene. Hvis det metalliske metallet eller elementet har mer enn en valens, er det spesifisert i parenteser og med romersk antall i henhold til aksje -nomenklaturen.
For eksempel FEH3 kalles jernhydrid (III), og COH2 Cobalt Hydro (II). Disse samme hydridene kan også utnevnes ved hjelp av den systematiske nomenklaturen, som benytter seg av de greske tallene (DI, Tri, Tetra, etc.). Dermed FEH3 kalles jerntrihydrid, og COH2 Cobalt Dihydruro.
Den klassiske nomenklaturen er ikke mye brukt til hydros. For eksempel er nah kjent mer som natriumhydrid, og ikke natriumhydrid.
 Natriumhydrid
Natriumhydrid Hvordan dannes hydros?
Ioniske eller saltvannshydror
De dannes ved reaksjon av hydrogen med et metall som tilhører gruppen av alkaliske metaller eller gruppen av alkalisk-terraterimetaller.
I Hydrors trent med disse metallene finnes hydrogen i H -formen-, kjent som hydridanion.
Alkalinmetaller (litium, natrium, kalium, rubidium og cesium) reagerer med hydrogen for å danne deres tilsvarende hydurns:
2 m (l)+h2(g) → 2MH (S)
Kan tjene deg: enhetsoperasjonerMetall m når reagering er i flytende tilstand, og hydrogen i gassformig tilstand, så reaksjonen krever høye temperaturer og høyt trykk. Tenk på følgende eksempel:
2 Li (L) +H2 (g) → 2 lih (er)
Reaksjonen av hydrogen med alkaliske tredjedels metaller (beryllium, magnesium, kalsium, strontium og barium), for hydriddannelse, er lik den som er observert med alkaliske metaller.
Magnesium og beryllium danner hydrider, men deres bindinger med hydrogen er av den kovalente typen; Det vil si ikke -ioniske, i motsetning til andre alkaliske metaller:
CA (L) +H2 (g) → CAH2 (S)
Molekylære hydror
Hydrogen kan reagere med ikke -metaller, tilsvarende gruppe 14, 15, 16 og 17 i det periodiske tabellen, for å danne molekylære hydror. Tenk for eksempel for dannelse av fluorhydrid ved kombinasjon eller direkte blanding av hydrogen med fluor:
H2 (g) +f2 (g) → 2 hf (g)
HF er mer kjent som hydrogenfluorid, men det kalles også fluorhydrid.
Hydrogen kan også reagere med oksygen (gruppe 16 i den periodiske tabellen) etter samme ordning:
2 h2 (g) +eller2 (g) → 2 H2O (g)
Reaksjonen krever varmeforsyning for å produsere hydrogenoksid (vann) eller oksygenhydrid.
Hydrogen kan også reagere med nitrogen, som tilhører gruppe 15 av det periodiske tabellen for å danne nitrogenhydrid, bedre kjent som ammoniakk (NH3).
N2 (g) +3 h2 (g) → 2 nh3 (g)
Reaksjonen krever varmeforsyning, høyt trykk og tilstedeværelse av katalysatorer (de akselererer kjemiske reaksjoner).
Metallhydror
De dannes ved reaksjonen av overgangsmetaller (gruppe 3, 4, 5, 6, 10, 11 og 12 i det periodiske tabellen) med hydrogen. Overgangsmetaller i gruppe 7, 8 og 9 danner imidlertid ikke forbindelser med hydrogen, et fenomen kjent som hydridgap eller gaphydrid.
Et unikt kjennetegn ved overgangsmetallhydror er at de ikke alltid presenterer en fast andel mellom antall hydrogenatomer og antall atomer som er til stede i hydrid. Det vil si at deres formler og strukturer ikke er enkle å representere.
Bruker/applikasjoner av hydros
 Hydros er veldig til stede i en av de mange typer batterier: som NIMH. Kilde: Multicherry, CC BY-SA 4.0, via Wikimedia Commons
Hydros er veldig til stede i en av de mange typer batterier: som NIMH. Kilde: Multicherry, CC BY-SA 4.0, via Wikimedia Commons Hydros er til stede i nikkelmetalliske hydridbatterier (NIMH), brukt i fellesskap med sjeldne jordmetaller, kobolt eller mangan. Flere metallhydror er blitt undersøkt for bruk i elbiler kjørt av hydrogenrelaterte celler.
Kan tjene deg: Redox Balance Metode: Trinn, eksempler, øvelserReduserende midler
Litiumhydrid og natriumbor (NABH4) De brukes som kjemiske reaksjoner i organiske synteseaksjoner.
Hydrogenlagring og annen relatert bruk
Det er piloter med hydrogenbruk som drivstoff i motorvogner, men på grunn av dens eksplosivitet har bruken av det vært begrenset som drivstoff. Bruken av hydros er blitt foreslått som en form for hydrogenlagring, for å kontrollere faren deres.
I tillegg har hydrors blitt brukt til rensing og separasjon av hydrogen- og temperatursensorer.
Tørkemidler
Kalsiumhydrid brukes til å fjerne vannet som er til stede i organiske løsningsmidler.
Syrer har sin opprinnelse med molekylære hydror
For eksempel: saltsyre dannes av løsningen i et vandig medium av klorhydrid (HCl), ved bruk av saltsyre i eliminering av oksider som dekker jern, forsuring av oljebrønner, produksjon av klorid av kalsium og mineral behandling.
Gjødsel
Ammoniakk (NH3) Det er et hydrid som brukes som en flytende gjødsel og serverer for syntese av forbindelser med ammoniumnitrat og ammoniumsulfat, som brukes som gjødsel.
Vann
Er det viktigste hydridet. Det brukes i mange bransjer med forskjellige bruksområder og applikasjoner. Vann er det viktigste som er ansvarlig for eksistensen av levende vesener.
Eksempler på hydror
Til slutt vil andre eksempler på hydror være oppført med sine respektive formler og navn:
SNH4: tinnhydrid | PH3: Fosforhydrid (fosfin) eller fosfor -trihydrid |
KH: Blyhydrid | MGH2: magnesiumhydrid eller magnesiumdihydruro |
KH: Kaliumhydrid | CH4: Carruro Carruro eller karbon tetrahydrid (metan) |
CAH2: Kalsiumhydrid | FEH2: Jernhydrid (II) |
Nah: natriumhydrid | ZnH2: sinkhydrid |
LIH: Litiumhydrid | Bah2: Bariumhydrid |
CSH: Cesiumhydrid | BH3: Bor Hydro (BAS |
Beh2: Beryl eller Beryl dihydridhydrid | SIH4: Silisiumhydro (Silan) |
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wojes, Ryan. (27. august 2020). Hva er et metallhydrid? Gjenopprettet fra: Thoughtco.com
- Amerikanske elementer. (2020). Hydridider. Hentet fra: Amerikanementer.com
- Wikipedia. (2020). Hydrid. Hentet fra: i.Wikipedia.org
- Tandis Arani. (15. august 2020). Hydridider. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Redaktørene av Enyclopaedia Britannica. (2020). Hydrid. Gjenopprettet fra: Britannica.com