Strontium hydroxide (SR (OH) ₂)

- 764
- 186
- Anders Mathisen
 Strontiumhydroksyd
Strontiumhydroksyd Hva er strontiumhydroksyd?
Han Strontiumhydroksyd (Sr (OH) ₂) er en uorganisk kjemisk forbindelse dannet av et strontiumion (SR) og to hydroksydioner (OH). Denne forbindelsen oppnås ved å kombinere et strolsalt med en sterk base, noe som resulterer i en forbindelse av alkalisk natur hvis kjemiske formel er SR (OH)2.
Generelt brukes for fremstilling av strontiumhydroksyd, natriumhydroksyd (NaOH) eller kaliumhydroksyd (KOH) som en sterk base. På den annen side er strontiumsalt (eller strontiumion) som reagerer med den sterke basen nitratet til strontium sr (nei3)2 Og prosessen er beskrevet ved følgende kjemiske reaksjon:
2KOH + SR (nei3)2 → 2Kno3 + Sr (OH)2
I løsning strontiumkation (SR+) Han kommer i kontakt med hydroksydanion (OH-) danner et grunnleggende ionisk strontiumsalt. Siden strontium er et alkalisk metall, regnes strontiumhydroksid som en kaustisk alkaliforbindelse.
Oppnå strontiumhydroksyd
I tillegg til den tidligere forklarte prosessen, kan det sies at når reaksjonen er utført, SR (OH)2 Utfelling i løsningen. Så blir dette utsatt for vask- og tørkeprosessen, og får til slutt et veldig fint hvitt pulver.
En alternativ metode for å oppnå strontiumhydroksid er fra oppvarming av strontiumkarbonat (SRCO3) eller strontiumsulfat (SRSO4), med damp ved en temperatur mellom 500 ° C og 600 ° C. Den kjemiske reaksjonen oppstår som vist nedenfor:
SRCO3 + H2O → SR (OH)2 + Co2
SRS + 2H2O → SR (OH)2 + H2S
Kan tjene deg: svovelsyreKjemisk struktur og fysisk -kjemiske egenskaper
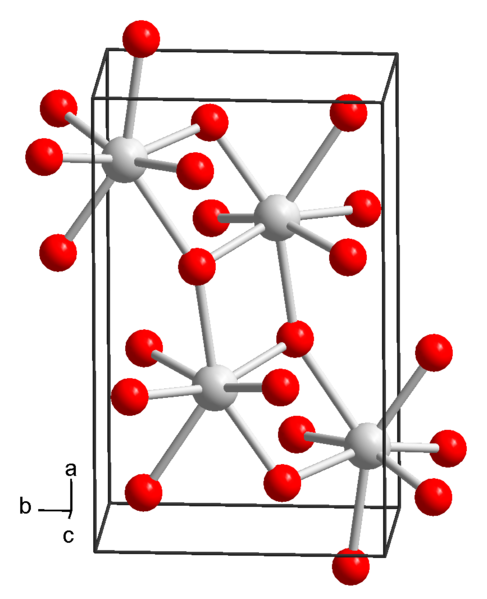 Kjemisk struktur av strontiumhydroksyd. Kilde: Wikimedia Commons
Kjemisk struktur av strontiumhydroksyd. Kilde: Wikimedia Commons For tiden er 3 former for strontiumhydroksid kjent: oktahydrat, monohydrat og vannfri.
Octonated Strontium hydroxide
Fra løsninger i normal temperatur- og trykkforhold (25 ° C og 1 atm), utfeller stronthydroksyd på en oktahydrat måte, hvis kjemiske formel er SR (OH)2∙ 8H2ENTEN.
Denne forbindelsen har en molmasse på 265,76 g/mol, en tetthet på 1,90 g/cm og presipitater som tetragonale krystaller (med romlig gruppe P4/NCC) av kvadrangulært prismatisk utseende og fargeløs.
På samme måte har Octonized Strontiumhydroxide evnen til å absorbere atmosfærisk fuktighet, siden det er en lett deilig forbindelse.
Monohydrert strontiumhydroksyd
I henhold til optiske mikroskopistudier (utført av røntgendiffraksjonsteknikken), ved å heve temperaturen til omtrent 210 ° C - et konstant atmosfæretrykk - SR (OH)2∙ 8H2O Det er dehydrert og transformert til monohydrert strontiumhydroksid (SR (OH)2∙ H2ENTEN).
Denne formen av forbindelsen har en molmasse på 139,65 g/mol og smeltetemperaturen er -73,15 ° C (375K). På grunn av sin atomkonfigurasjon, presenterer dette mindre løselighet i vann enn det som er beskrevet i sin oktahydratform.
Vannfri strontiumhydroksyd
Ved å fortsette med systemtemperaturøkningen til omtrent 480 ° C, forlenges dehydrering til et vannfri strekkhydroksyd.
I motsetning til de hydratiserte former, har den en molmasse på 121,63 g/mol og en tetthet 3,625 g/cm3. Kokepunktet er nådd ved 710 ° C (1.310 ° F eller 983 K) mens smeltepunktet er ved 535 ° C (995 ° F eller 808 K).
Kan tjene deg: Ididio 192Løselighet
Strontium oktahydrathydroksyd har vannløselighet på 0,91 gram per 100 milliliter (målt ved 0 ° C), mens dens vannfrie form ved lignende temperaturforhold har en løselighet på 0,41 gram per 100 milliliter.
Tilsvarende anses dette stoffet som uoppløselig i aceton og helt oppløselig i syrer og ammoniumklorid.
Kjemisk reaktivitet
Strontiumhydroksyd er ikke brannfarlig, den kjemiske reaktiviteten forblir stabil ved moderate temperaturer og trykk, og er i stand til å absorbere karbondioksid fra atmosfærisk luft, og transformere det til strontiumkarbonat.
I tillegg er det en alvorlig irriterende forbindelse hvis du kommer i kontakt med huden, luftveiene eller andre slimhinner.
Strontiumhydroksydbruk
På grunn av dets hygroskopiske egenskaper og grunnleggende egenskaper, brukes strontiumhydroksid for forskjellige applikasjoner i bransjen:
- Moice ekstraksjon og sukker raffinering fra rødbeter.
- Plaststabilisator.
- Fett og smøremidler.
Moice ekstraksjon og raffinering av rødbeter sukker
På begynnelsen av det 21. århundre, i Tyskland, begynte strekkhydroksid å bli brukt til raffinering av rødbeter, gjennom den patenterte prosessen av Carl Scheibler i 1882.
Denne prosedyren består i blandingen av strontiumhydroksyd og sukkerholdig redeform, noe som resulterer i et uoppløselig disakkarid. Denne løsningen skilles ved dekantasjon, og når raffineringsprosessen er utført, oppnås sukker som et sluttprodukt.
Selv om denne prosedyren fremdeles brukes, er det andre metoder med mye mer etterspørsel etter å være billigere, som brukes i det store flertallet av verdens sukkerraffinerier. For eksempel Barsil -metoden, som bruker bariumsilikat, eller Steffen -metoden, ved bruk av kalk som et avtrekksmiddel.
Kan tjene deg: Anomic Carbon: Hva er, egenskaper, eksemplerStrontium fett
De smører fett som inneholder strontiumhydroksid. Disse er i stand til å holde seg sterkt til overflater med metallegenskaper, er vannbestandige og støtter plutselige temperaturendringer.
På grunn av deres gode fysiske og kjemiske stabilitet, brukes disse fettstoffene som industrielle smøremidler.
Plaststabilisator
De aller fleste plast, som blir utsatt for klimatiske faktorer som sol, regn og atmosfærisk oksygen, modifiserer egenskapene deres og nedbryter.
På grunn av sin betydelige vannmotstand blir strontiumhydroksid tilsatt til disse polymerene - i løpet av fusjonsfasen - som fungerer som en stabilisator i fremstilling av plastprodukter for å forlenge dets levetid.
Andre apper
- I malingsindustrien brukes det som et essensielt tilsetningsstoff for å akselerere tørkeprosessen i kommersielle og industrielle malerier.
- Fra strontiumhydroksid, er salter eller strontiumioner oppnådd, som brukes som råstoff for produksjon av pyrotekniske artikler.
Referanser
- Wikipedia (n.d.). Strontiumhydroksyd. Innhentet fra.Wikipedia.org
- Pubchem (s.F.). Strontiumhydroksyd. Hentet fra Pubchem.NCBI.NLM.NIH.Gov
- Honeywell (s.F.). Stontiumhydroksydoktahydrat. Hentet fra Honeywell.com

