Kaliumhydroksydstruktur, egenskaper, bruker

- 637
- 164
- Thomas Karlsen
Han kaliumhydroksyd Det er et hvitt krystallinsk uorganisk fast stoff. Den kjemiske formelen er KOH. Krystallene absorberer lett luft fra luften, så det sies at det er en hygroskopisk forbindelse. Det er en sterk base og absorberer karbondioksid (CO2) av miljøet.
Industri forekommer gjennom elektrolyse av kaliumklorid (KCl). Av grunner til energibesparing og produktrenhet brukes kvikksølvceller (HG) i denne metoden.
 Kaliumhydroksydperler (KOH). Ingen maskinlesbar forfatter gitt. Walkerma antatt (basert på copyright -krav). [Public Domain] Kilde: Wikipedia Commons
Kaliumhydroksydperler (KOH). Ingen maskinlesbar forfatter gitt. Walkerma antatt (basert på copyright -krav). [Public Domain] Kilde: Wikipedia Commons Men i mange år har det vært bekymring for forurensning av kvikksølv som genererer denne prosessen. Faktisk er utslipp for avfallsavløp som inneholder kvikksølv strengt forbudt forbudt. Det er andre prosesser som membran og membran.
Det er også ikke-elektrokjemiske prosesser som nedbrytning av kaliumnitritt (KNO2) I nærvær av jernoksid (tro2ENTEN3).
KOH-løsninger oppnådd i industrielle prosesser fordamper for å oppnå KOH ved 90-95%. 5-10% vannresterinnholdet er knyttet til KOH i form av kaliumhydroksydmonohydrat (KOH.H2ENTEN).
På grunn av de kaustiske egenskapene og dens sterke basisitet har den veldig varierte applikasjoner. Det fungerer som råstoff i såper og vaskemidler, trykk eller kosmetikkblekk, blant annet bruk. Det brukes også til å vaske industrikasser, i påvisning av sopp med mikroskop og har anvendelse i matindustrien.
Selv om det er en veldig stabil forbindelse, er den klassifisert som etsende. Det må manipuleres nøye, da det kan forårsake brannskader i øyne, hud og slimhembraner.
[TOC]
Struktur
KOH -krystallen ved vanlige temperaturer er monoklinisk, med hvert kaliumatom (K) omgitt av en octaedro forvrengt fra oksygenatomer (O). På sin side danner hydroksyl (OH) -grupper en sikk-sakk-formet kjede koblet av hydrogener, der O-O-avstander er 3,35 A, og kasserer en betydelig hydrogenbinding.
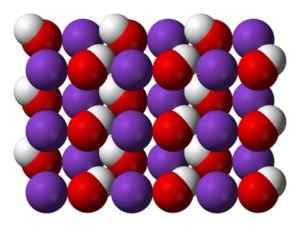 Krystallinsk struktur av KOH ved vanlige temperaturer. Blå: Kalium, rødt: oksygen, hvitt: hydrogen. Benjah-BMM27 [Public Domain]. Kilde: Wikipedia Commons
Krystallinsk struktur av KOH ved vanlige temperaturer. Blå: Kalium, rødt: oksygen, hvitt: hydrogen. Benjah-BMM27 [Public Domain]. Kilde: Wikipedia Commons Ved høye temperaturer har KOH en kubikk krystallinsk form.
Det kan tjene deg: Cruise for Crucible: Egenskaper, funksjoner, bruk eksemplerNomenklatur
- Kaliumhydroksyd.
- Caustic Potassa.
- Kaliumhydrat.
- Kalium blekemiddel.
Egenskaper
Fysisk tilstand
Hvit krystallinsk faststoff.
Molekylær vekt
56.106 g/mol.
Smeltepunkt
380 ºC; 406 ºC er også rapportert (det varierer i henhold til vanninnholdet). Den tekniske graden (90-92% KOH) smelter omtrent 250 ºC.
Kokepunkt
1327 ºC.
Tetthet
2.044 g/cm3
Løselighet
Løselig i kaldt vann (107 g/100 ml ved 15 ºC) og varmt vann (178 g/100 ml ved 100 ° C). Oppløsningen i vann er en veldig eksoterm prosess, dette betyr at en stor mengde varme genereres.
Løselig i alkoholer. Løselig i glyserin. Uoppløselig i eter.
Ph
13,5 (i 0,1 molar vandig løsning).
Andre egenskaper
Krystallene er delikat eller hygroskopisk, noe som betyr at den absorberer luft fra luften. Absorberer også lett CO2 fra luft.
Dets kjemiske reaksjoner er egenskapene til en sterk base. I vandig oppløsning reagerer den med enhver svak syre for å danne kaliumsalt av syre. For eksempel reagerer den med kullsyre (h2Co3) eller med karbondioksid (CO2) For å danne bikarbonat eller kaliumkarbonat.
Reagerer med alkoholer for å danne kaliumalcoxides, eller med hydrogensulfid H2S for å danne sulfid eller kaliumbisulfid.
I vandige systemer danner KOH flere hydrater: mono-, di- og tetra-hydrater.
KOH vandige oppløsninger er fargeløse, sterkt grunnleggende, såpe og kaustisk. Det er et korrosivt materiale, både solid og i løsning.
Det er ikke brannfarlig, men når den blir oppvarmet til nedbrytningen avgir giftig og etsende røyker av K2ENTEN.
Forårsaker alvorlige forbrenninger i øyne, hud og slimhinner og i kontakt med metaller, som aluminium, tinn, bly eller sink, kan generere utviklingen av hydrogengass (h2), som er svært brennbar.
Varmen som produseres når den kommer i kontakt med fuktighet eller andre stoffer kan forårsake nok varme til å slå på brennbare materialer.
applikasjoner
I produksjonen av andre kaliumforbindelser
Kaliumhydroksid brukes som råstoff for kjemisk og farmasøytisk industri. Det tjener til å produsere kaliumkarbonat (k2Co3), Kaliumpermanganat (KMNO4), kaliumfosfat (k3Po4), kaliumsilikat (k2Sio3) og kaliumcyanid (KCN), blant andre forbindelser.
Kan tjene deg: lineære alkaner: struktur, egenskaper, nomenklatur, eksemplerI flere applikasjoner
Den høye renheten KOH har anvendelse innen plantevernmidlerproduksjon, blekk og fargestoffer syntese, kjemikalier for gummi eller galvanoplastikk, litografi, etc.
Den tekniske graden KOH brukes som råstoff i vaskemidler og såperindustri; i fremstilling av kosmetikk, glass og tekstiler; å avsvise råolje; som et tørkemiddel og ved fjerning av malerier og lakker, blant andre applikasjoner.
Det er også nyttig som et kaustisk middel i treindustrien, i bomulls Mercerization, i analytisk kjemi for alkalimetriske titler, organisk og vannbehandling.
I medisinske applikasjoner
I medisin brukes det i våt montering under fremstilling av kliniske prøver for mikroskopisk visualisering av sopp og andre soppelementer i skinn, hår, negler, blant andre.
KOH -preparat brukes til å avklare det kliniske materialet slik at soppelementene kan sees lettere.
Et klinisk prøvefragment tilsettes en 10% KOH -løsningsdel på en glassglid. Dekk deretter med et dekkobjekt og la stå ved romtemperatur for å tillate fordøyelse av vertsceller. Til slutt observeres det med mikroskopet.
 Mikroskop. Kontantin Kolosov -bilde. Kilde: Pixabay
Mikroskop. Kontantin Kolosov -bilde. Kilde: Pixabay På den annen side er KOH i form av aktuell løsning effektiv i behandlingen av vorter.
I kosmetikkindustrien
Det brukes i noen negler rengjøringsprodukter, barberkremer og såper, da dens korrosive eiendom gjør den veldig effektiv i nedbrytning eller fjerning av bløtvev og hårfjerning.
 Såper. Rituelt bilde. Kilde: Pixabay
Såper. Rituelt bilde. Kilde: Pixabay I landbruket
Det brukes i gjødsel og andre landbruksprodukter som ugressmidler og plantevernmidler.
I industrielle kjemiske prosesser
KOH er nyttig i rengjøring og rensing av industrikasser, spesielt når det er nødvendig for å fjerne syrer.
Kan tjene deg: Henderson-Haselbalch ligning: forklaring, eksempler, treningFor eksempel for at det er lett å reagere med CO2, Den brukes til å absorbere denne gassen. I tillegg er det ideelt å reagere med syrer, så det tjener til å fjerne sulfhydronsyre (H2S). Og på samme måte for å fjerne nitrogenoksider.
 Industriell prosess. Michael Gaida -bilde. Kilde: Pixabay
Industriell prosess. Michael Gaida -bilde. Kilde: Pixabay I matindustrien
Det brukes til å justere pH, som en stabilisator og som et fortykningsmiddel i matindustrien.
Det har blitt vurdert av US Food and Drug Administration, eller FDA (for forkortelsen for engelsk Food and Drug Administration), Som en direkte ingrediens hos mennesker, forutsatt at den brukes under forhold relatert til god produksjonspraksis.
Ved å få biodiesel
Biodiesel er en diesel- eller dieselstatningsbrennbar væske. Det er hentet fra vegetabilske oljer eller animalsk fett. KOH har blitt brukt som katalysator i biodieselproduksjon.
Nylige studier
I flere år blir oppmerksomheten rettet mot forurensningen av havene på grunn av plastavfall, noe som rammer mer enn 550 arter av marin fauna, både for inntak av plast og for å bli fanget mellom avfallet.
Av denne grunn prøver vi å finne metoder som tillater prosessering av fordøyelseskanalprøver av dyr, oppløser det organiske materialet, men uten å løse opp plasten som er inntatt av prøvene.
I denne forstand har det blitt funnet at bruk av KOH -løsninger for å skille plast fra organisk materiale er en praktisk og effektiv metode, som kan være veldig nyttig i kvantitative studier av inntak av plast ved dyrelivet dyreliv.
Referanser
- Mahmoud a. Ghanoum og Nancy C. Iseham. (2009). Dermatofytter og dermatofytose. I klinisk mykologi. Andre utgave. Gjenopprettet fra Scientedirect.com.
- Kühn, s. et al. (2016). Bruken av kaliumhydroksyd (KOH) -løsning som en passende tilnærming til å isolere plast inntatt av marine organismer. I marin forurensningsbulletin. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Volum 19. Fjerde utgave. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A22. VCH Verlagsgellschaft MBH.
- National Library of Medicine. (2019). Kaliumhydroksyde. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Krisada nooiroj, et al. (2009). I sammenlignende studie av KOH/AL2ENTEN3 og KOH/Nay -katalysatorer for biodieselproduksjon via transcessterifisering fra palmeolje. I fornybar energi. Gjenopprettet fra Scientedirect.com.
- « Organisasjonsverdier Kjennetegn, betydning, eksempler
- Alsacia og Lorena territorium, bakgrunn, verdenskriger »

