Hydroksider
- 4206
- 505
- Prof. Joakim Johansen
Hva er hydroksider?
De Hydroksider De er uorganiske og ternære forbindelser som består av samspillet mellom en metallkation og den funksjonelle gruppen OH (hydroksydanion, OH-). De fleste av dem er av ionisk karakter, selv om de også kan ha kovalente bindinger.
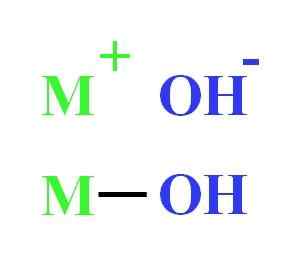
For eksempel kan et hydroksyd representeres som elektrostatisk interaksjon mellom kation m+ og anion oh-, eller som den kovalente unionen gjennom M-OH-lenken (nedre bilde). I den første er den ioniske bindingen gitt, mens den andre kovalente. Dette faktum avhenger i det vesentlige av metall eller kasjon+, så vel som belastningen og ionradioen.
 Hydroksydrepresentasjon. Kilde: Gabriel Bolívar
Hydroksydrepresentasjon. Kilde: Gabriel Bolívar Fordi mye av dem kommer fra metaller, tilsvarer det dem som metallhydroksider.
Hvordan dannes hydroksider?
Det er to viktigste syntetiske ruter: ved reaksjon av det tilsvarende oksid med vannet, eller med en sterk base i et surt medium:
MO + H2O => m (å)2
MO + H+ + Åh- => M (å)2
Bare de vannoppløselige metalloksider reagerer direkte for å danne hydroksid (første kjemiske ligning). Andre er uoppløselige og krever syrearter som frigjør m+, som deretter samhandler med OH- Fra sterke baser (andre kjemiske ligning).
Imidlertid er disse sterke basene NaOH, KOH og andre fra de alkaliske metallene (LIOH, RBOH, CSOH) metallhydroksider (CSOH). Dette er svært oppløselige ioniske forbindelser i vann, derfor deres OH- De står fritt til å delta i kjemiske reaksjoner.
På den annen side er det uoppløselige metallhydroksider, og følgelig er de veldig svake baser. Selv noen av dem er sure, som tilfellet er med tellursyre, TE (OH)6.
Hydroksid etablerer en løselighetsbalanse med løsningsmidlet rundt den. Hvis det for eksempel er vann, blir balansen uttrykt som følger:
M (å)2 M2+(AC) + OH-(AC)
Hvor (ac) betegner at mediet er vandig. Når det faste stoffet er uoppløselig, er OH -oppløst konsentrasjon liten eller foraktelig. Av denne grunn kan uoppløselige metallhydroksider ikke generere løsninger så grunnleggende som NaOH.
Fra ovenstående kan det trekkes ut at hydroksider viser veldig forskjellige egenskaper, knyttet til den kjemiske strukturen og interaksjonene mellom metall og OH. Selv om mange er ioniske, med varierte krystallinske strukturer, har andre i stedet komplekse og rotete polymere strukturer.
Hydroksydegenskaper
Å anion-
Hydroksylion er et oksygenatom knyttet til et hydrogen. Dermed kan dette lett representeres som OH-. Den negative belastningen er lokalisert på oksygen, noe som gjør denne anionen til en artsgiver av elektroner: en base.
Hvis OH- Gjort sine elektroner til et hydrogen, dannes et H -molekyl2ENTEN. Du kan også donere elektronene dine til positive belastningsarter: som metallsentre m+. Dermed dannes et koordineringskompleks gjennom M-OH-dativkoblingen (oksygen gir paret av elektroner).
Imidlertid, for at dette skal skje, må oksygen kunne koordinere effektivt med metall, ellers vil interaksjoner mellom M og OH ha en markert ionisk karakter (M+ Åh-).
Kan tjene deg: Volumetrisk pipette: Kjennetegn, bruk, kalibrering og feilSiden hydroksylionet er den samme i alle hydroksider, ligger forskjellen mellom dem alle i kationen som følger med den.
På samme måte fordi denne kationen kan komme fra et hvilket.
Ionisk og grunnleggende karakter
Hydroksider, selv om de har koordineringslenker, har en latent ionisk karakter. I noen, for eksempel NaOH, er ionene en del av et krystallinsk nettverk som består av NA -kationer+ og å anioner- i proporsjoner 1: 1; det vil si for hvert naion+ Det er et OH -ion- av motstykke.
Avhengig av metallbelastning, vil det være mer eller mindre oh -anioner- rundt det. For eksempel for en metallkation m2+ Det vil være to OH -ioner- samspill med ham: m (å)2, Hva er skisser som Ho- M2+ Åh-.
På samme måte som det oppstår med metaller m3+ og med andre mer positive kostnader (selv om de sjelden overstiger 3+).
Denne ioniske karakteren er ansvarlig for mange av de fysiske egenskapene, for eksempel fusjons- og kokepunkter. Disse er høye, noe som gjenspeiler de elektrostatiske kreftene som fungerer i det krystallinske nettverket. Når hydroksider blir oppløst eller smeltet, kan de også utføre elektrisk strøm på grunn av mobiliteten til ionene sine.
Imidlertid har ikke alle hydroksider de samme krystallinske nettverkene. De med de mest stabile, vil være mindre utsatt for å oppløses i polare løsningsmidler som vann. Som en generell regel er jo mer ulik de ioniske radioene til M+ Og åh-, Mer løselig vil være den samme.
Periodisk trend
Ovennevnte forklarer hvorfor løseligheten av alkalisk metallhydroksider øker når gruppen går ned. Dermed er den økende rekkefølgen av løseligheter i vann for disse som følger: Lioh ÅH- Det er en liten anion, og etter hvert som kation blir mer klumpete, svekker det krystallinske nettverket energi. På den annen side danner alkalinotrous metaller mindre oppløselige hydroksider på grunn av deres største positive belastninger. Dette er fordi m2+ Det tiltrekker seg mer kraft til OH- sammenlignet med m+. På samme måte er kationene mindre, og derfor mindre ulik størrelse sammenlignet med OH-. Resultatet av dette er det eksperimentelle beviset på at NaOH er mye mer grunnleggende enn CA (OH)2. Den samme resonnementet kan brukes på andre hydroksider, enten for de av overgangsmetaller, eller for de av P -blokken (Al, PB, TE, etc.). Også den mindre og store ioniske radius og den positive belastningen på m+, mindre. Et eksempel på dette skjer med berylhydroksyd, BE (OH)2. Han være2+ Det er en veldig liten kation og dens divalente belastning gjør den elektrisk veldig tett. M hydroksider (OH)2 reagerer med syrer for å danne en aquocompleks, det vil si m+ ender omgitt av vannmolekyler. Imidlertid er det et begrenset antall hydroksider som også kan reagere med basene. Dette er de som er kjent som amfoteroshydroksider. Anfoterhydroksider reagerer både med syrer og baser. Den andre situasjonen kan representeres med følgende kjemiske ligning: M (å)2 + Åh- => M (å)3- Men hvordan jeg kan avgjøre om et hydroksyd er amfoter? Gjennom et enkelt laboratorieeksperiment. Fordi mange metalliske hydroksider er uoppløselige i vann, og tilfører en sterk base til en løsning med M -ioner+ oppløst for eksempel til3+, Det vil utfelle det tilsvarende hydroksyd: Til3+(AC) + 3OH-(Ac) => Ah (OH)3(S) Men å ha et overskudd av OH- Hydroksyd fortsetter å reagere: Al (å)3(S) + OH- => Al (å)4-(AC) Som et resultat løses det nye negative belastningskomplekset av vannmolekylene rundt. De hydroksider som forblir uendret med ekstra -base -tilsetningen oppfører seg ikke som syrer, og er derfor ikke amfotiske. Hydroksider kan ha krystallinske strukturer som ligner på mange salter eller oksider; noen enkle, og andre veldig kompliserte. I tillegg kan de der det er en reduksjon i ionisk karakter presentere metallsentre forent av oksygenbroer (Hom-O-MOH). I løsning er strukturene forskjellige. Selv om det for veldig oppløselige hydroksider er nok å betrakte dem som ioner oppløst i vann, er det for andre nødvendig å ta hensyn til koordineringskjemi. Dermed hver kation m+ Det kan koordineres til et begrenset antall arter. Jo mer klumpete, jo større antall vann eller OH -molekyler- knyttet til ham. Herfra oppstår den berømte koordinasjonen oktaedron av mange metaller oppløst i vann (eller i noe annet løsningsmiddel): m (åh2)6+n, å være lik den positive metallbelastningen. Cr (OH)3, For eksempel virkelig en oktaedron. Som? Tatt i betraktning forbindelsen som [CR (OH2)3(ÅH)3], hvorav tre av vannmolekylene erstattes av OH -anioner-. Hvis alle molekyler ble erstattet av OH-, Da ville den negative belastningen og oktaedriske strukturkomplekset [CR (OH) oppnås6]3-. Belastningen -3 er resultatet av de seks negative ladningene til OH-. Hydroksider kan betraktes som "hydratiserte oksider". Imidlertid er "vann" direkte kontakt med m+; mens du er i fuktige oksider mo · nh2Eller, vannmolekyler er en del av en ekstern koordineringssfære (de er ikke i nærheten av metall). Disse vannmolekylene kan ekstraheres gjennom oppvarming av en hydroksydprøve: M (å)2 + Q (varme) => mo + h2ENTEN MO er det metalliske oksydet som er dannet som et resultat av hydroksyddehydrering. Et eksempel på denne reaksjonen er det som blir observert når cupric hydroxide, Cu (OH) er dehydrert2: Cu (OH)2 (blå) + q => cuo (svart) + h2ENTEN Hva er den riktige måten å nevne hydroksider? IUPAC reiste tre nomenklinger for dette formålet: den tradisjonelle, bestanden og det systematiske. Det er riktig å bruke noen av de tre, men for noen hydroksider kan det være mer behagelig eller praktisk å nevne det på en eller annen måte. Den tradisjonelle nomenklaturen består ganske enkelt av å tilsette den høyeste valensen som metallet presenterer; og suffikset -bare det laveste. For eksempel, hvis metall m har valenser +3 og +1, hydroksyd M (OH)3 Det vil bli kalt hydroksyd (metallnavn)ICO, Mens MOH hydroksyd (metallnavn)Bjørn. For å bestemme hva metallet Valencia i hydroksid er nok til å observere tallet etter OH lukket i parenteser. Dermed M (OH)5 Det betyr at metallet har en belastning eller valens på +5. Hoved ulempen med denne nomenklaturen er imidlertid at den kan være komplisert for metaller med mer enn to oksidasjonstilstander (som med krom og mangan). For slike tilfeller brukes hyper- og hyperprefikser for å betegne de høyeste og laveste valensene. Således, hvis M i stedet for bare å ha valenser +3 og +1, har den også +4 og +2, så er navnene på dets største hydroksider og mindre valens: hydroksyd hyper(Metallnavn)ICO, og hydroksyd hikke(Metallnavn)Bjørn. Av alle nomenklinger er dette det enkleste. Her blir navnet på hydroksyd ganske enkelt fulgt av valencia av metallet låst i parenteser og skrevet i romertall. Igjen for M (OH)5, For eksempel vil aksje nomenklatur være: hydroksid (metallnavn) (v). (V) Denota da (+5). Til slutt er den systematiske nomenklaturen preget av å ty til multiplikatorprefikser (Di-, tri-, tetra-, penta-, heksa-, etc.). Disse prefiksene brukes til å spesifisere både antall metallatomer og OH -ioner-. På denne måten M (OH)5 Det heter: Pentahidroxide of (Metal Name). I tilfelle av HG2(ÅH)2, For eksempel ville det være dihydroksid; Et av hydroksidene hvis kjemiske struktur er kompleks ved første blikk. Noen eksempler på hydroksider og deres tilsvarende nomenklinger er de som følger: -NaOH (natriumhydroksyd) -CA (OH) 2 (kalsiumhydroksyd) -Tro (å)3 (Jernhydroksyd; jernhydroksyd (III); eller jerntrihydroksyd). -V (OH)5 (Pervanathydroksyd; vanadiumhydroksid (V); eller vanadium pentahidroxide). -Sn (å)4 (Hydroksyd isñico; tinnhydroksyd (IV); eller tinn tetrahydroxide). -Ba (oh)2 (Bariumhydroksyd eller bariumdihydroksid). -MN (OH)6 (Mangan hydroksyd, manganhydroksid (VI) eller mangan heksahydroksyd). -Augah (argisk hydroksyd, sølvhydroksid eller sølvhydroksyd). Merk at for denne forbindelsen er det ingen skille mellom lager og systematiske nomenklinger. -PB (OH)4 (Plúmbisk hydroksyd, blyhydroksid (IV) eller bly tetrahydroxide). -LIOP (litiumhydroksid). -CD (OH) 2 (kadmiumhydroksid). -Ba (oh)2 (Bariumhydroksyd). -Kromhydroksyd.Anfoterisme
Strukturer
Dehydreringsreaksjon
Hydroksyd nomenklatur
Tradisjonell
Lager
Systematisk
Eksempler på hydroksider
 Natriumhydroksydutseende
Natriumhydroksydutseende  Utseende av fast tilstand kalsiumhydroksyd
Utseende av fast tilstand kalsiumhydroksyd Referanser

