Viktigheten av periodisk tabell 8 grunner
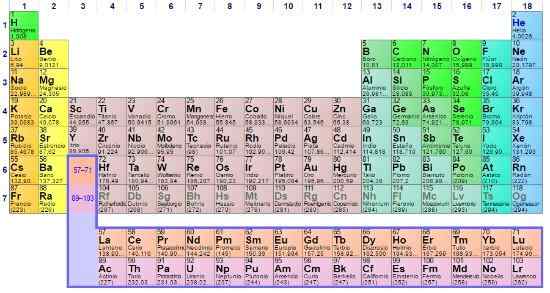
- 1249
- 88
- Mathias Aas
De Viktigheten av det periodiske bordet Han er ubestridelig for det enkle faktum at han i mer enn hundre år har støttet forskere til å bestille alle kjemiske elementer, og vil fortsette å gjøre det for resten av menneskelig eksistens. Det er en slags bygning med eksperimentelle og teoretiske baser som oppsummerer egenskapene til kjent materie.
Selv om flere modeller er utviklet før den periodiske tabellen til den russiske kjemikeren Dmitri Mendeleev, har formålet alltid vært den samme: orden, finn og forutsi kjemiske elementer som deler egenskaper til felles. Dermed avslører posisjonene eller boksene i denne tabellen mer informasjon enn det som kan intervjues med det blotte øye.
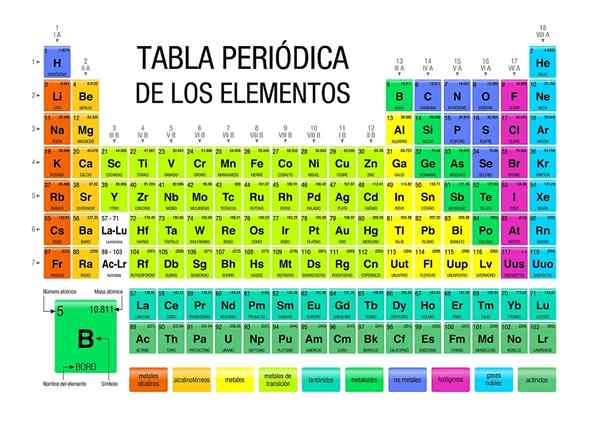 Den periodiske tabellen er et ikon og vitenskapelig verktøy der kjemi, fysikk, historie og litteratur konvergerer
Den periodiske tabellen er et ikon og vitenskapelig verktøy der kjemi, fysikk, historie og litteratur konvergerer Det periodiske tabellen er til stede på alle nivåer av akademisk trening, til og med å være et ikon av generell kunnskap. Selv om det er viktig i kjemi, er sannheten at det også er viktig innen fysikk og biologi, i tillegg til å være en kilde til studier og inspirasjon for elskere av historie og litteratur.
Det er grunnen til at noen av grunnene til at det periodiske bordet er viktig.
Hva er viktigheten av den periodiske tabellen?
Du kan gi forskjellige grunner som forklarer viktigheten av dette vitenskapelige verktøyet:
Det er grunnlaget for uorganisk kjemi

Uorganisk kjemi er praktisk talt studiet av den periodiske tabellen. Uten det ville all kunnskapen oppnådd rundt denne typen materie komme ned. De som er dedikert til denne grenen av kjemi, er det viktig at de kan lese og trekke ut all informasjonen som denne tabellen tilbyr om de kjemiske elementene utover karbon og dens isotoper.
For organiske kjemikalier, tar mange ganger en titt på høyre side av det periodiske bordet: mer presist mot toppen av blokken p, der karbon er lokalisert og flere ikke -metaller.
Kan tjene deg: TritioPå den annen side må uorganiske kjemikere gjennomgå alle metaller som utgjør blokkene d og F, så vel som gruppe 18 av edle gasser, så de ender opp med å bli kjent med alle kjemiske elementer; bortsett fra kanskje de som er syntetiske og svært radioaktive.
Kaster lys over kjemisk kunnskap
Før den periodiske tabellen og de første forsøkene på å bestille de kjemiske elementene basert på dets likheter, ble kjemi pakket inn i en usikker aura og mystikk.
Ingen visste nøyaktig hvor mange eller som var alle de kjemiske elementene som kunne eksistere i naturen. Takket være denne tabellen er det kjent i dag at vi maksimalt har 118 elementer. Det som virket mørkt før, nå er klart, forståelig og organisert.
Tillater å forutsi egenskapene til nye elementer
I begynnelsen inneholdt den periodiske tabellen tomme mellomrom, fordi flere av de kjemiske elementene ikke hadde blitt oppdaget.
Plasseringene av disse områdene indikerte at det nye elementet, i samsvar med sine jevnaldrende, måtte reagere på lignende måte; Og enda mer, det kan til og med finnes i de samme mineralkildene.
Og det var faktisk i den kjemiske behandlingen av mineralsymfiner der de manglende kjemiske elementene sakte ble oppdaget; For eksempel Gallium, Germanio og Scandio. Gallium, for å være under aluminium, måtte dele egenskaper med sistnevnte og danne mineraler (oksider, sulfider, klorider, etc.) samme type.
Hvis element 119 ble opprettet, måtte det nødvendigvis være lokalisert under Francio, i gruppe 1; og reagerer eller har derfor kjemiske egenskaper som ligner på de andre alkaliske metaller (litium, natrium, kalium, etc.).
Kan tjene deg: fortynningsfaktorForskjell og klassifisere kjemiske elementer
I den periodiske tabellen er det mulig å observere hvordan elementene er klassifisert og tilgjengelige i bestemte områder eller grupper. For eksempel er ikke -metaller orientert mot øverste høyre.
I mellomtiden integrerer metallene, som utgjør de fleste elementene, venstre side og midten av bordet, så vel som blokken F: De to radene nedenfor.
Hver gruppe oppført fra 1 til 18, definerer en familie av elementer. De av gruppe 1 kalles alkaliske metaller, de av gruppe 2, alkalinotrous metaller, de av 3, gruppen av Scandio, og så videre. Noen grupper har unike navn, for eksempel gruppe 16 eller oksygen, som kalles kalsogener eller amfumoer.
Lagre enorme mengder informasjon
I de periodiske tabellene kan vi se oksidasjonstallene for hvert element, deres ioniseringsenergier, dens gjennomsnittlige atommasse, dets elektroniske konfigurasjoner, elektronegativiteter og hele settet med dets periodiske egenskaper.
I noen tabeller er det til og med mulig å finne informasjon om dens normale fusjons- og kokepunkter, så vel som de krystallinske strukturene i dets faste stoffer. I denne forstand vises mer spesialiserte periodiske tabeller enn andre, avhengig av arbeid og faglig nivå.
Avklarer periodiske trender
Etter gruppene og rekkene i det periodiske tabellen, er det mulig å tydelig observere hvordan de periodiske egenskapene endrer seg når vi beveger oss fra ett element til et annet.
For eksempel avtar atomradius gjennom en rad, fra venstre mot høyre, men øker når vi stiger ned av en gruppe. Også den metalliske karakteren øker fra topp til bunn, og fra høyre til venstre.
Spår arten av forbindelsene som dannes
Forbindelsene dannes når to eller flere elementer reagerer på hverandre. Avhengig av deres respektive posisjoner i det periodiske tabellen, er det mulig å forutsi hva den kjemiske naturen til denne forbindelsen vil være.
Kan tjene deg: hydrogenbromid (HBR)For eksempel, hvis metallisk natrium og gassklor reagerer, vil de gi opphav til natriumklorid, et salt. Dette er fordi natrium er et metall, mens klor en ikke -metall, hvis forskjeller mellom elektronegativitetene er store, og dermed favoriserer dannelsen av en ionisk forbindelse.
Det er et vindu for vitenskapens historie
 Marie Curie
Marie Curie Hvert element har sin historie og oppdagere. Bare navnene deres er reflekser eller de som oppdaget dem, fra de geografiske regionene der de ble trukket ut i sine rene former, eller den karakteristiske fargen på sineralene. For eksempel skylder heliumgass navnet sitt nettopp fordi det ble identifisert i solen.
I det periodiske bordet ser vi et stykke av livet til Antoine Lavoisier, Marie Curie, Carl Willhelm Scheele, Henry Cavendish, Paul Emile Lecog og mange andre forskere som bidro til å fullføre bordet når de oppdaget nye kjemiske elementer.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Hvorfor er periodebordet viktig? Gjenopprettet fra: Thoughtco.com
- Ben p. Stein. (28. mai 2019). Det periodiske bordet: Det er mer enn bare kjemi og fysikk. Gjenopprettet fra: NIST.Gov
- Dennis Rouvray. (10. januar 2019). Periodebordet var kjemiens viktigste knekking. New Scientist Ltd. Gjenopprettet fra: Newscientist.com
- Wanda Thibodeaux. (26. april 2018). Viktigheten av en periodisk tabell. Gjenopprettet fra: Scienting.com
- « Ugjennomsiktige objekter konsept, egenskaper og eksempler
- Live Matter -konsept, egenskaper og eksempler »

