Isopentano struktur, egenskaper, bruk
- 995
- 18
- Dr. Andreas Hopland
Han Isopentano Det er en organisk forbindelse hvis kondenserte formel er (CH3)2Chch2Ch3. Det er en alkan, spesielt en forgrenet isomer av pentanen, preget av å være en svært flyktig væske og bruker som et glitrende middel. For øyeblikket er det mest anbefalte navnet av IUPAC 2-metylbutan.
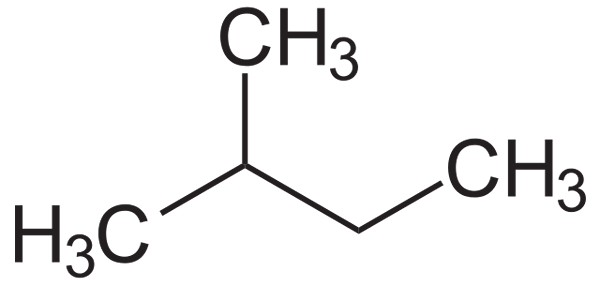
I det nedre bildet kan dets strukturelle formel sees. Merk at en gruppe CH3 Effektivt er det knyttet til karbon 2 i butylkjeden. Fra isopentano oppnås isopentil eller isopentil radikal.
 Strukturformel i isopentano. Kilde: Neurotoger / Public Domain
Strukturformel i isopentano. Kilde: Neurotoger / Public Domain Isopentano er en apolar, hydrofob og brennbar forbindelse. Lukten ligner på bensin, og er en del av sammensetningen, da den øker oktan- eller oktannummeret. Det oppnås fra isomeriseringsreaksjonen til n-Pentano, selv om det naturlig oppnås i få mengder innen naturgassreserver.
Isopentano blir lagt igjen til side. En person kan innta det og lukte det i moderasjon før de er uønskede symptomer, for eksempel ønske om å kaste opp og svimmelhet. Isopentano finner du i barberkremer og hårbalsam.
[TOC]
Isopentano -struktur
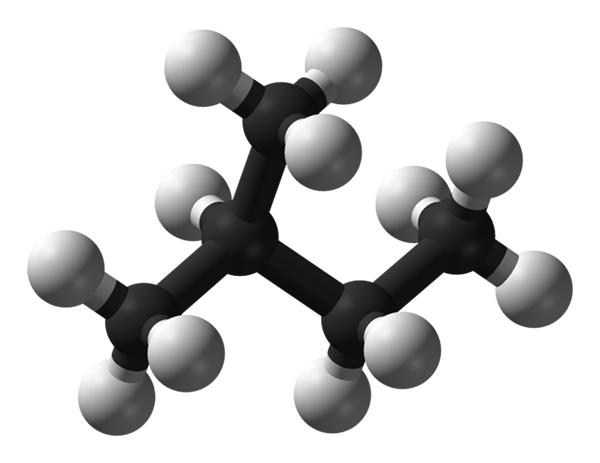 Isopentano molekylstruktur. Kilde: Benjah-BMM27 via Wikipedia.
Isopentano molekylstruktur. Kilde: Benjah-BMM27 via Wikipedia. I det overordnede bildet har vi molekylstrukturen i Isopentano, representert med en modell av kuler og barer. De svarte kulene tilsvarer karbonatomer, mens de hvite kulene til hydrogenatom. Av det kullsyreholdige skjelettet kan sies at det er robust, forgrenet og klumpete.
Kan tjene deg: ForskyvningsreaksjonEndene av isopentano -molekylet forstås av CH -grupper3, som er ineffektive når det gjelder å styrke intermolekylære interaksjoner. Isopentano -molekyler er avhengige av de spredende kreftene i London og deres masser for å kunne holde seg sammenhengende, og dermed definerer en væske i normal temperatur- og trykkforhold.
Imidlertid dens geometri og gruppene3 De er ansvarlige for at isopentano -væsken er svært flyktig og koker ved en temperatur på 28.2 ºC. For eksempel den lineære isomeren n-Pentano koker rundt 36 ° C, som er en refleksjon av de beste intermolekylære interaksjonene.
Til tross for sin tilsynelatende robusthet, er Isopentano -molekylet i stand til å ta i bruk flere romkonfigurasjoner, en nøkkelfaktor for å etablere glasset sitt ved en temperatur på -160 ºC.
Egenskaper
Fysisk utseende
Flytende eller fargeløs gass, med et vandig utseende, og som også gir en lukt som ligner på bensin. Det er et svært flyktig stoff.
Smeltepunkt
Isopentano krystalliserer et temperaturintervall mellom -161 og -159 ºC.
Kokepunkt
Isopentano koker med et temperaturintervall mellom 27.8 og 28.2 ºC. Derfor blir den knapt utsatt utenfor beholderen din vil begynne å koke og løsne store volum med damp.
Damptrykk
76.9 kPa ved 20 ºC (ca.76 atm)
Tetthet
0.6201 g/ml ved 20 ºC. Isopentano damper er 2.48 tettere enn luft.
Løselighet
Isopentano for å være et apolært stoff, er uoppløselig og ikke blandbar med vann og noen alkoholer. Det er oppløselig og blandbar i parafinlige løsningsmidler, etere, karbontetraklorid, og også i aromatiske væsker som toluen.
Kan tjene deg: kvartære forbindelser: egenskaper, trening, eksemplerBrytningsindeks
1.354
Overflatespenning
15 dyn/cm ved 20 ºC
Goo
0.214 CP ved 20 ºC
Flash Point
-51 ºC. Denne temperaturen gjør isopentano.
Selvordemperatur
420 ºC
applikasjoner
 Kjærlighetskremer inneholder små isopentano -mengder som fungerer som drivmiddel og gir produkttekstur. Kilde: Pixabay.
Kjærlighetskremer inneholder små isopentano -mengder som fungerer som drivmiddel og gir produkttekstur. Kilde: Pixabay. Isopentano er et organisk løsningsmiddel som fungerer som et reaksjonsmiddel for visse organiske syntese, og representerer også råstoffet for produksjon av andre forbindelser.
Det tilsettes bensin for å øke oktanen, og til flere kosmetiske produkter for å forbedre tekstur, for eksempel barberkremer, fordamper og etterlater seg en gang en boblende masse.
Tilsvarende blir polystyren fuktet i Isopentano slik at plasten utvides når den fordamper, utvides for å skape et slags skum, som kar, modeller, plater, brett osv.
På den annen side brukes isopentano i kryogeni, sammen med tørris og flytende nitrogen, for å fryse biologiske vev og prøver.
Å skaffe
Isopentano kan fås fra naturgassreservoarene, men bare 1% av innholdet.
En annen rute, den mest brukte på industrielt nivå, er basert på n-Destillat pentan av oljeraffineringsprosesser. Så han n-Pentano gjennomgår en spesiell reaksjon kalt isomerisering.
Formålet med isomerisering av n-Pentano skal skaffe sine mest forgrenede isomerer. Dermed har vi ikke bare isopentano, men også neopentano. Denne reaksjonen er mulig ved å bruke veldig spesifikke metallkatalysatorer, som kontrollerer hvilken temperatur og hvilke trykk som kreves.
Det kan tjene deg: egenskaper til kovalente forbindelser (med eksempler)Risiko
Isopentano regnes som et ikke -toksisk stoff. Dette skyldes delvis den lave reaktiviteten, siden C-C- eller C-H-koblingene ikke er enkle å bryte, så de forstyrrer ikke som sådan i noen metabolsk prosess. Faktisk er en person i stand til å inhalere høye mengder av damper før han kveles, uten å tilsynelatende lide av sikkerhetsskader.
Inntaket forårsaker kvalme og oppkast, og hudkontakten hans ender. På den annen side har ikke medisinske studier vært i stand til å spesifisere om isopentano er et kreftfremkallende stoff. Imidlertid regnes det som et farlig miljøgifter for marine økosystemer og deres fauna.
Den største faren rundt Isopentano er ikke så mye dens reaktivitet, men dens brennbarhet: den brenner med oksygenet i luften. Og fordi væsken er svært ustabil, vil den minste flukt løsne mange av sine damper mot miljøet, noe som vil tenne minst nærheten til en flamme eller annen kilde til varme.
Det er grunnen til at produkter som inneholder Isopentano, må lagres i trygge og friske miljøer.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Isopentan. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Isopentan. PubChem -database. CID = 6556. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Elsevier f.V. (2020). Isopentan. Scientedirect. Hentet fra: Scientedirect.com
- Jennifer b. Galvin & Fred Marashi. (2010). 2-metylbutan (isopentan). Journal of Toxicology and Environmental Health, en del av aktuelle spørsmål. Volum 58, 1999 -Essue 1-2. gjør jeg.org/10.1080/009841099157403
- « Saponifiable lipideregenskaper, struktur, funksjoner, eksempler
- Profesjonelle etiske egenskaper, betydning, kode, eksempler »

