Joseph Thomson

- 5065
- 718
- Jonathan Carlsen
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856-1940) Det var en britisk kjemiker High. Han vant Nobelprisen i fysikk i 1906.
Han ble født i Cheetam Hill, et Manchester -distrikt, England, 18. desember 1856. Også kjent som "J.J."Thomson studerte ingeniørfag ved Owens College, for tiden en del av University of Manchester, og deretter matematikk i Cambridge.
I 1890, j.J. Thomson giftet seg med Rose Elizabeth Paget, datter av doktor Sir Edward George Paget, som hun fikk to barn med: en jente, som heter Joan Paget Thomson, og et barn, George Paget Thomson.
Sistnevnte ville bli en kjent forsker og i 1937 en nobelpris i fysikk for sitt arbeid med elektroner.
Fra ung alder fokuserte Thomson studiene på atomstrukturen, og oppdaget dermed eksistensen av elektroner og isotoper, blant mange andre av deres bidrag.
I 1906 mottok Thomson Nobelprisen i fysikk, "som anerkjennelse av den store fortjenesten til hans teoretiske og eksperimentelle forskning om ledning av elektrisitet gjennom gasser", som opprettet av juryen i dommen fra den nevnte prisen.
I 1908 ble han utnevnt til ridder av den britiske kronen og fungerte som æresprofessor i fysikk i Cambridge og Royal Institute, London.
Han døde 30. august 1940 i en alder av 83 år, i byen Cambridge, England. Fysikeren ble gravlagt i Westminster Abbey, nær Sir Isaac Newtons grav.
Bidrag fra Joseph Thomson til vitenskap og kjemi
Elektronoppdagelse
I 1897, j.J. Thomson oppdaget en ny lyspartikkel enn hydrogen, som ble døpt "elektron".
Det kan tjene deg: Bestemmelse av aske: Metoder og eksemplerHydrogen ble betraktet som en atomvektmålingsenhet. Inntil den tid var atomet den minste delingen av materie.
I denne forstand var Thomson den første som oppdaget de negativt lastede korpuskulære subatomiske partiklene.
Thomson Atomic Model
Thomsons atommodell var strukturen som den engelske fysikeren tilskrev atomer. For forskeren var atomer en positiv ladningsfære.
Det ble innebygd negativt fordelt elektroner jevnt på den positive lastskyen, det vil si nøytralisering av den positive belastningen på atomdeigen.
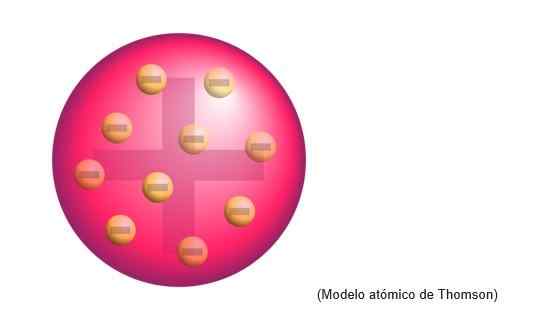
Denne nye modellen erstatter utdypet av Dalton og vil senere bli tilbakevist av Rutherford, Thomsons disippel i Cavendish Laboratories of Cambridge.
Separasjon av atomer
Thomson brukte positive eller anodiske stråler for å skille atomer fra forskjellig masse. Denne metoden tillot ham å beregne strømmen som transporteres av hvert atom og antall molekyler per kubikkcentimeter.
Å kunne dele atomene med forskjellig masse og belastning, og fysikeren oppdaget eksistensen av isotoper. Også på denne måten, med sin studie av positive stråler, produserte han stort fremskritt mot massespektrometri.
Oppdagelse av isotoper
J.J. Thomson oppdaget at neonioner hadde forskjellige masser, det vil si forskjellig atomvekt. Slik viste Thomson at neonen har to undertyper av isotoper, neon-20 og neon-22.
Isotopene, studert frem til i dag, er atomer av det samme elementet, men kjernene deres har forskjellige massetall, siden de er sammensatt av forskjellige mengder nøytroner i sentrum.
Eksperimenter med katodestråler
Katodestråler er elektronstrømmer i vakuumrør, det vil si glassrør med to elektroder, en positiv og ett negativt.
Kan tjene deg: kromhydroksid: struktur, egenskaper, syntese, brukNår den negative elektroden blir oppvarmet, også kalt katode, avgir den stråling som er rettet mot den positive elektroden, eller anoden, i en rett linje hvis ingen magnetfelt oppstår i den ruten.
Hvis glassveggene i røret er dekket med fluorescerende materiale, produserer katodens kupp mot det laget projeksjonen av lys.
Thomson studerte oppførselen til katodestråler og kom til konklusjonene om at strålene spredte seg rett.
Han konkluderte også med at disse strålene kunne bli avledet fra banen deres ved tilstedeværelsen av en magnet, det vil si av et magnetfelt. I tillegg kan strålene bevege bladene med styrken til elektronene som sirkulerer, og dermed demonstrere at elektronene hadde masse.
J.J. Thomson opplevde gassen inne i katodestrålerøret, men atferden til elektroner varierte ikke. På samme måte varmet katodestrålene gjenstandene som interponerte på veien mellom elektroder.
Avslutningsvis hadde Thomson vist at katodestråler hadde lette, mekaniske, kjemiske og termiske effekter.
Katodestrålerørene og deres lysegenskaper var transcendentale for den påfølgende oppfinnelsen av Tube Television (CTR) og videokameraer.
Massespektrometer
J.J. Thomson skapte en første tilnærming til Massespektrometer. Dette verktøyet tillot forskerstudien.
Med denne undersøkelsen konkluderte han med at katodestrålene var sammensatt av negative belastningskorpuskler, som er inne i atomene, og dermed postulerer atomets delbarhet og gir opphav til elektronfiguren.
Det kan tjene deg: smørsyre: formel, egenskaper, risikoer og brukFremskritt innen massespektrometri fortsatte også til i dag, og utviklet seg i forskjellige metoder for å skille elektronene fra atomer.
I tillegg var Thomson den første som antydet Den første bølgeguiden i 1893. Dette eksperimentet besto av spredning.
Bølgeguider vil bli mye brukt i fremtiden, også i dag, med dataoverføring og optisk fiber.
Thomsons arv
Thomson (TH) ble etablert som en massebelastningsenhet i massespektrometri, foreslått av kokker og rockwood-kjemikalier, til ære for Thomson.
Denne teknikken gjør det mulig å bestemme fordelingen av molekylene i et stoff i henhold til deres masse og gjenkjenne av dette, som er til stede i en prøve av materie.
Thomson Formula (TH):
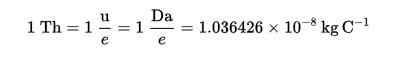
Fremragende verk
- Discelling of Electricity Through Gases, Electricity Through Gases (1900).
- Den korpuskulære teorien om materie, elektronet i kjemi og erindringer og refleksjoner (1907).
- Beyond the Electron (1928).
Referanser
- Nobel Media AB (2014). J. Thomson - Biografisk. Nobel pris.org. Nobel pris.org.
- Thomson, Joseph J., Elektrisitet gjennom gassatferd. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Den diskrete sjarmen til elementære partikler.
- Christen, Hans Rudolf, Grunnleggende om generell og uorganisk kjemi, bind 1. Barcelona, Spania. Utgaver Reverté s.TIL., 1986.
- Arzani, Aurora Cortina, Elementær generell kjemi. Mexico, Porrúa redaksjon, 1967.
- R. G. Kokker, a. L. Rockwood. Rapid Commun. Massespektrom. 5, 93 (1991).

