Leucinegenskaper, struktur, funksjoner, biosyntese
- 3166
- 360
- Marius Aasen
De Leucin Det er en av de 22 aminosyrene som utgjør proteinene fra levende organismer. Dette tilhører en av de 9 essensielle aminosyrene som ikke er syntetisert av kroppen og må konsumeres med matinntak i kostholdet.
Leucina ble først beskrevet i 1818 av den franske farmasøyten og kjemikeren. L. Proust, som kalte det "oksid-sak". Senere tilberedte Erlenmeyer og Kunlin det fra a-benzoilamido-ß-isopropilakrylsyre, hvis molekylære formel er C6H13NO2NO2.
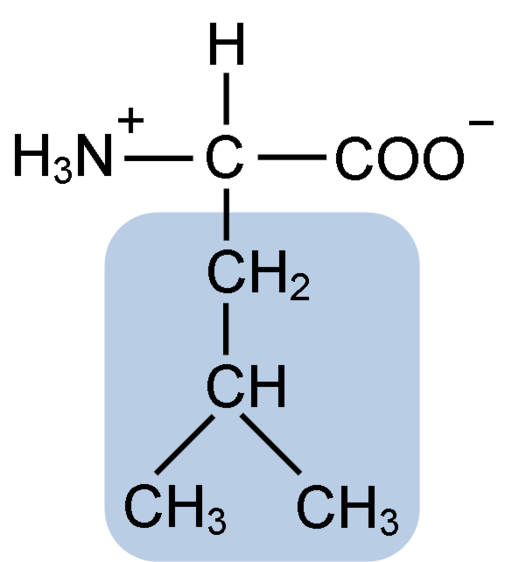
 Kjemisk struktur av leucinaminosyren (fuen: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Kjemisk struktur av leucinaminosyren (fuen: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) Leucin var nøkkelen under oppdagelsen av følelsen av proteinoversettelse, siden dens hydrofobe struktur tillot biokjemisten Howard Dentzis å markere hydrogenet til karbon 3 og observere betydningen av aminosyrer er inkorporert i peptidsyntesen av hemoglobin.
Proteinene kjent som "glidelås" eller "stengninger" av Leucina er sammen med "sinkfingrene", de viktigste transkripsjonsfaktorene til eukaryote organismer. Leucine glidelåser er preget av deres hydrofobe interaksjoner med DNA.
Generelt blir ikke proteinene rike på leucin eller konstituert av forgrenede aminosyrer metabolisert i leveren, i stedet går de direkte til musklene der de raskt brukes til proteinsyntese og oppnå energi.
Leucin er en aminosyre av forgrenet kjede som er nødvendig for biosyntesen av proteiner og aminosyrer av melk, som er syntetisert i brystkjertlene. Du kan finne store mengder av denne frie aminosyren inne i morsmelk.
Blant alle aminosyrene som utgjør proteiner, er leucin og arginin de mest tallrike, og begge er blitt påvist i proteinene til alle kongedømmene som utgjør livets tre.
[TOC]
Kjennetegn
Leucin er kjent som den essensielle aminosyren i forgrenet kjede, den deler den typiske strukturen med de andre aminosyrene. Imidlertid kjennetegnes det fordi sidekjeden eller R -gruppen har to karbonatomer koblet, og den siste er knyttet til et hydrogenatom og to metylgrupper.
Det tilhører gruppen av polare aminosyrer uten belastning, substituentene eller R -gruppene av disse aminosyrene er hydrofobe og ikke -polar natur. Disse aminosyrene er de viktigste ansvarlige for intra-proteiske hydrofobe interaksjoner og har en tendens til å stabilisere strukturen til proteiner.
Alle aminosyrer, som har et sentralt karbon som er chiral (karbon α), det vil si at det har fire forskjellige forente substituenter, de kan finnes på to forskjellige måter i naturen; Dermed er det D- og L-Leucina, sistnevnte typiske i proteinstrukturer.
Begge former for hver aminosyre har forskjellige egenskaper, deltar i forskjellige metabolske ruter og kan til og med endre egenskapene til strukturene de er del.
For eksempel har leucin i L-Leucina en litt bitter smak, mens den i sin d-leucin-form er veldig søt.
Formen av aminosyre er lettere å metabolisere av pattedyrens kropp. L-Leucina blir lett degradert og utnyttet for konstruksjon og beskyttelse av proteiner.
Struktur
Leucin består av 6 karbonatomer. Det sentrale karbonet, vanlig i alle aminosyrer, er knyttet til en karboksylgruppe (COOH), en aminogruppe (NH2), et hydrogenatom (H) og en sidekjede eller R R -gruppe sammensatt av 4 karbonatomer.
Kan tjene deg: MesothelioKarbonatomer i aminosyrer kan identifiseres med greske bokstaver. Nummereringen begynner fra karboksylsyren (COOH) karbon, mens merknaden med det greske alfabetet begynner fra det sentrale karbonet.
Leucin har som en substituent gruppe i sin R-kjede R til en isobutyl- eller 2-metylpropilgruppe som er produsert ved tap av et hydrogenatom, med dannelse av en alkylradikal; Disse gruppene fremstår som forgreninger i aminosyrestrukturen.
Funksjoner
Leucin er en aminosyre som kan tjene som ketogen forløper for andre forbindelser involvert i sitronsyresyklusen. Denne aminosyren representerer en viktig kilde for syntese av acetyl-CoA eller acetoacetyl-CoA, som er en del av formasjonsveiene til ketonlegemene i leverceller.
Det er kjent at leucin er uunnværlig i insulinsignalveier, som deltar i begynnelsen av proteinsyntese og unngår tap av protein på grunn av nedbrytning.
Vanligvis er de indre strukturer av proteiner sammensatt av hydrofobe aminosyrer som leucin, valin, isoleucin og metodin. Slike strukturer er vanligvis bevart for vanlige enzymer blant levende organismer, som for cytokrom c.
Leucin kan aktivere metabolske ruter i brystkjertelceller for å stimulere laktosesyntese, lipider og proteiner som oppfyller funksjoner som signalmolekyler i reguleringen av energihomeostasen til de unge hos pattedyr.
Leucinrike domener er en essensiell del av spesifikke DNA -bindende proteiner, som generelt er strukturelle diametre på en superinnmeldt måte og som er kjent som "leucin glidelåsproteiner".
Disse proteinene har som en særegen karakteristikk et regelmessig mønster av gjentatte leuciner sammen med andre hydrofobe aminosyrer som er ansvarlige for å regulere fagforeningene til transkripsjonsfaktorer til DNA og mellom forskjellige transkripsjonsfaktorer.
Leucin zip proteiner kan danne homo-eller heterodimerer som tillater dem.
Biosyntese
Alle aminosyrer for forgrenede kjede, inkludert leucin, er hovedsakelig syntetisert i planter og bakterier. I blomstrende planter er det en betydelig økning i leucinproduksjon, siden det er en viktig forløper for alle forbindelser som er ansvarlige for aromaen av blomster og frukt.
En av faktorene som tilskrives den store overflod av leucin i de forskjellige bakteriepeptidene er at 6 forskjellige kodoner av den genetiske koden koden for leucin (UUA-Uug-UCU-CUC-CUA-cug), det samme er også for arginin.
Leucin syntetiseres i bakterier fra en fem -trinns rute som bruker som utgangspunkt en ketacid relatert til valinen.
Denne prosessen er regulert fra alosterisk, slik at når det er et overskudd av leucin inne i cellulær, hemmer det enzymene som deltar i ruten og stopper syntesen.
Kan tjene deg: Simpson Index: Formula, Tolkning and ExplieBiosintetisk rute
Biosyntesen av leucin i bakterier begynner med omdannelsen av et derivatketacid av valinen, 3-metyl-2-oksobutanoat i (2S) -2-isopropilmalat, takket være enzymet 2-isopropilmalto, som bruker acetyl -Coa og vann til det formålet.
(2S) -2-isopropilmalaatet mister et vannmolekyl og blir transformert til 2-isopropilmaleat med 3-isopropylmalatdehydratase. Deretter tilfører det samme enzymet et annet vannmolekyl og transformerer 2-isopropilmaleato til (2R-3S) -3-isopropilm.
Den sistnevnte forbindelsen blir utsatt for en oksidorreduksjonsreaksjon som fortjener deltakelse av et NAD+molekyl, som produserer (2S) -2-isopropil-3-oksosuksinasjon, noe som er mulig med deltakelse av enzymet 3- isopilmalato delebrogenase.
(2S) -2-osopropyl-3-oksosukcinasjon mister et karbonatom i form av CO2 spontant, og genererer 4-metyl-2-oksopentanoat som ved handling av en transaminase av forgrenede kjedeaminosyrer (transaminase leucin, spesielt) Og med samtidig frigjøring av L-glutamat og 2-oksoglutarat, produserer det L-Leucina.
Nedbrytning
Hovedrollen til leucin er å fungere som en signalering som forteller cellen at det er tilstrekkelige aminosyrer og energi til å begynne syntesen av muskelproteiner.
Nedbrytningen av forgrenede kjedeaminosyrer når leucin begynner med en transaminering. Dette og de to påfølgende enzymatiske trinnene blir katalysert av de tre enzymene i tilfelle av leucin, isoleucin og valin.
Transaminering av de tre aminosyrene produserer de a-ecotoacidiske derivater av disse, som er utsatt for en oksidativ dekarboksylering for å produsere acyl-CoA-tioés som er a, β-dishydrogenert for å utføre tioés de acil-CoA α, β-insomfatet for.
Under leucinkatabolisme avdekkes den tilsvarende acyl-CoA-avdekkingen, β-nettmettet ß-på-dustatus (HMG-CoA), som er mellomledd i kolesterolbiosyntese og andre isoprenoider.
Katabolsk rute av Leucina
Fra dannelsen av acyl-CoA-onkelen a, ß-umettet som stammer fra leucinen, avviker de katabolske rutene til denne aminosyren og valinen og isoleucinen betydelig.
Acyl-CoA Ucion a, β-nettmettet leucina blir behandlet nedstrøms av tre forskjellige enzymer kjent som (1) 3-metylcrotonyl-CoA karboksylase, (2) 3-metylglutakonil-CoA hydratasa og (3) 3-hydroxi -3-metylglutaril -Coa liasa.
Hos bakterier er disse enzymene ansvarlige for konvertering av 3-metylcrotronyl-CoA (leucindederivat) i 3-metylglutaconil-CoA, i 3-hydroksy-3-metylglutaril-CoA og i acetoacetat og acetyl-CoA, henholdsvis.
Leucinet som er tilgjengelig i blodet utnyttes for syntese av muskel/myofibrillære proteiner (MPS). Dette fungerer som en aktiverende faktor for denne prosessen. Samvirke også direkte med insulin, påvirke tilførselen av
Leucin rik mat
Forbruket av rike aminosyreproteiner er uunnværlig for den cellulære fysiologien til levende organismer og leucin er intet unntak blant essensielle aminosyrer.
Proteiner oppnådd fra meieriserum regnes som de rikeste i L-Leucina-rester. Imidlertid gir all mat med høyt proteininnhold som fisk, kylling, egg og rødt kjøtt store mengder leucin for kroppen.
Kan tjene deg: Reproduksjon av virus: Faser og egenskaperMaisen i korn er dårlig i lysin- og tryptofanaminosyrer, den har veldig stive tertiære strukturer for fordøyelse og har liten verdi fra ernæringssynet, men det har høye nivåer av leucin og isoleucin.
Fruktene av belgfrukter er rike på nesten alle essensielle aminosyrer: lysin, treonin, isoleucin, leucin, fenylalanin og valin, men har lite innhold av metodin og cystein.
Leucin blir trukket ut, renset og konsentrert i tabletter som mattilskudd for idrettsutøvere med høyt konkurranse og markedsføres som et stoff. Hovedkilden for isolering av denne aminosyren tilsvarer soya -melene.
Det er et ernæringstilskudd brukt av idrettsutøvere for muskelregenerering kjent som BCAA (engelsk "Forgrenet kjede aminosyre "). Dette gir høye konsentrasjoner av forgrenede aminosyrer: Leucina, Valina og isoleucin.
Fordelene med inntaket ditt
Leucin rik mat hjelper til med å kontrollere overvekt og andre metabolske sykdommer. Mange ernæringsfysiologer påpeker at mat som er rike på leucin- og kosttilskudd basert på denne aminosyren, bidrar til regulering av matlyst og angst hos voksne.
Alle leucin -rike proteiner stimulerer muskelproteinsyntese; Det er vist at en økning i andelen av inntatt leucin med hensyn til de andre essensielle aminosyrene kan reversere dempningen av proteinsyntese i muskulaturen til eldre pasienter.
Selv personer med alvorlige makulære lidelser som er lammet, kan stoppe tapet av masse- og muskelstyrke med riktig oral leucintilskudd, i tillegg til å anvende systemiske øvelser av muskelresistens.
Leucin, valine og isoleucin er viktige komponenter i massen som utgjør skjelettmuskelen til virveldyr, så deres tilstedeværelse er viktig for syntese av nye proteiner eller for reparasjon av den eksisterende eksisterende.
Mangelforstyrrelser
Mangler eller misdannelser av α-Zo-State dehydrogenase-komplekset, som er ansvarlig for metabolisering av leucin, valin og isoleucin hos mennesker, kan forårsake alvorlige psykiske lidelser.
I tillegg er det en patologisk tilstand relatert til metabolismen til disse forgrenede kjede aminosyrene kalt "urinsykdom med arce sirup lukt".
Til dags dato er ikke eksistensen av bivirkninger på overdreven leucinforbruk påvist. Imidlertid anbefales en maksimal dose på 550 mg/kg daglig, siden det ikke har vært noen langsiktige studier relatert til overdreven vevseksponering for nevnte aminosyre.
Referanser
- Álava, m. D. C., Camacho, m. OG., & Delgadillo, J. (2012). Muskelhelse og forebygging av sarkopeni: Effekten av protein, leucin og ß-hydroksy-ß-metylbutirat. Bone and Mineral Metabolism Magazine, 10(2), 98-102.
- Phenheme, eller. R. (1993). Matkjemi (Nei. 664: 543). Anke.
- Massey, l. K., Sokatch, J. R., & Conrad, r. S. (1976). Forgrenet kjede amininosyrekatabolisme i bakterier. Bakteriologiske gjennomganger, 40(1), 42.
- Mathews, c. K., & Ahern, K. G. (2002). Biokjemi. Pearson Education.
- Bare, a. (1999). Leucintilskudd og intensiv trening. Sports medisin, 27(6), 347-358.
- Munro, h. N. (Red.). (2012). Pattedyrproteinmetabolisme (Vol. 4). Elsevier
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.

