Boyle Law
- 1033
- 295
- Jonathan Moe
Hva er Boyle's Law?
De lov av Boyle eller Boyle-Maleotte Law Det er en som uttrykker forholdet mellom trykket som utøves av eller på en gass, og volumet dette opptar; Fortsatt å holde både gasstemperaturen, så vel som dens mengde (antall føflekker).
Denne loven, sammen med den fra Charles, Gay-Lussac, Charles og Avogadro, beskriver oppførselen til en ideell gass; Spesielt i en lukket beholder underlagt volumendringer som utøves av en mekanisk kraft.
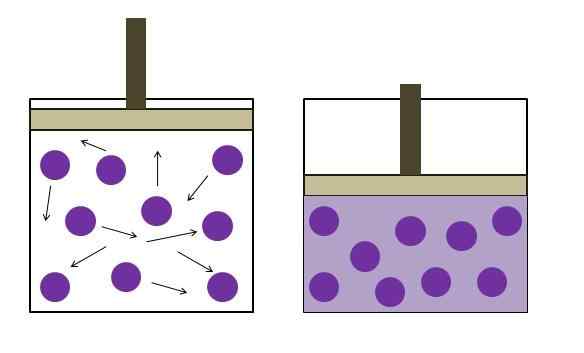
 Økt trykkreduksjonstrykk. Kilde: Gabriel Bolívar
Økt trykkreduksjonstrykk. Kilde: Gabriel Bolívar Det øvre bildet oppsummerer kort Boyle's lov. Lilla punkter representerer molekyler eller gassatomer, som kolliderer med de indre veggene i beholderen (til venstre). Ved å redusere det tilgjengelige rommet eller volumet til beholderen som er okkupert av denne gassen, økes kollisjonene, noe som betyr en økning i trykk (til høyre).
Dette viser at P- og volum V -trykket til gassen er omvendt proporsjonalt hvis beholderen er tett lukket; Ellers vil større trykk være lik en større utvidelse av beholderen.
Hvis en graf V mot P, med henholdsvis dataene fra V og P på aksene og og X, vil bli observert, vil en asymptotisk kurve bli observert. Jo lavere V, jo større er økningen i P; Det vil si at kurven vil strekke seg mot høye verdier av P på x -aksen.
Selvfølgelig forblir temperaturen konstant; Men hvis det samme eksperimentet ble utført ved forskjellige temperaturer, ville de relative posisjonene til disse kurvene v vs P endret seg på den kartesiske aksen. Endringen ville være enda tydeligere hvis den var grafer på en tre -dimensjonal akse, med konstant T på Z -aksen.
Historie om Boyle's Law
Bakgrunn
Siden forskeren Galileo Galilei uttrykte sin tro på eksistensen av tomrommet (1638), begynte forskere å studere egenskapene til luft og delvise hull.
Den angloirlandiske kjemikeren, Robert Boyle, begynte sin studie av luftegenskaper i 1638 etter å ha lært at Otto von Guericke, en tysk ingeniør og fysisk ingeniør, hadde bygget en flybombe.
Kan tjene deg: Bromin: Historie, struktur, elektronisk konfigurasjon, egenskaper, bruksområderKvikksølveksperiment
For å gjennomføre sine lufttrykksstudier, brukte Boyle et "J" formrør, hvis konstruksjon ble tilskrevet Robert Hooke, en Boyle -assistent. Den korte armenden ble forseglet, mens den lange armenden av røret var åpen for å plassere kvikksølvet.
Fra begynnelsen ønsket Boyle å studere elastisiteten til luft, kvalitativt og kvantitativt. Da kvikksølv strømmet gjennom den åpne enden av røret i form av "J", trakk Boyle at luften i den korte armen på røret ble inngått under presset fra Mercury.
Resultater
Jo større mengde kvikksølv tilsatt røret, jo større er trykket som utøves på luften og jo lavere volum. Boyle oppnådde et negativt eksponentielt diagram over luftvolumet avhengig av trykket.
I mellomtiden, hvis volumet av luften mot det omvendte trykket er plottet, er det en rett linje med positiv skråning.
I 1662 publiserte Boyle den første fysiske loven som ble gitt i form av en ligning, som indikerte funksjonell avhengighet av to variabler. I dette tilfellet, trykk og volum.
Boyle sa at det var et omvendt forhold mellom trykket som ble utøvd på en gass og volumet okkuperte den gassen, dette relativt sanne forholdet for virkelige gasser var. De fleste gasser oppfører seg som ideelle gasser til moderat trykk og temperaturer.
Når høyere trykk og lavere temperaturer oppstår, ble avvik fra oppførselen til de virkelige gassene i idealene mer bemerkelsesverdige.
Edme Mariotte
Den franske fysikeren Edme Mariotte (1620-1684) oppdaget uavhengig av samme lov i 1679. Men han hadde fortjenesten av å vise at volumet varierer med temperaturen. Det er grunnen til at det kalles Mariotte's Law eller Law of Boyle og Mariotte.
Styrking av loven
Daniel Bernoulli (1737) styrket Boyle's lov ved å påpeke at trykket på en gass produseres av virkningene av gasspartikler på veggene i beholderen som inneholder den.
Det kan tjene deg: nukleofil: nukleofilt angrep, typer, eksempler, nukleofilisitetI 1845 publiserte John Waterston en vitenskapelig artikkel, som fokuserer på hovedprinsippene i den kinetiske teorien om gasser.
Deretter konsoliderte Rudolf Clausius, James Maxwell og Ludqwig Boltzmann den kinetiske teorien om gasser, som relaterer trykket som utøves av en gass med hastigheten på gasspartikler i bevegelse i bevegelse i bevegelse.
Jo lavere volumet av beholderen som inneholder en gass, jo større er hyppigheten av virkningene av partiklene som danner den mot murene i beholderen; Og desto større er trykket utøvd av gassen.
Hva er denne loven?
Eksperimentene utført av Boyle, påpeker at det er et omvendt forhold mellom volumet okkupert av en gass og trykket som utøves på det. Imidlertid er det nevnte forholdet ikke helt lineært, som indikert med en volumvariasjonsgraf i henhold til trykket tilskrevet Boyle.
I Boyles lov indikeres det at volumet okkupert av en gass er omvendt proporsjonalt med presset. Det er også indikert at produktet av trykket til en gass etter volumet er konstant.
Matematisk uttrykk
For å komme til det matematiske uttrykket av Boyles lov, starter det fra:
V ∝ 1/P
Der det indikerer at volumet okkupert av en gass er omvendt proporsjonalt med trykket. Imidlertid er det en konstant som dikterer hvor omvendt proporsjonalt er dette forholdet.
V = k/p
Hvor k er proporsjonalitetskonstanten. Rydde k du har:
VP = k
Produktet av trykket til en gass med volumet er konstant. Så:
V1P1 = K og v2P2 = k
Og dette kan trekkes ut det:
V1P1 = V2P2
Sistnevnte er uttrykket eller den endelige ligningen for Boyle's lov.
Hva er den til? Hvilke problemer løser loven?
Dampmotorer
Boyle-Maleotte Law brukes i drift av dampmaskiner. Det er en ekstern forbrenningsmotor som bruker transformasjonen av den termiske energien til en mengde vann til mekanisk energi.
Vann varmes opp i en tett lukket kjele, og dampen som produseres utøver trykk i henhold til Boyle -loven som produserer en utvidelse av et sylindervolum ved å skyve et stempel.
Kan tjene deg: fortynningsfaktorStempelets lineære bevegelse blir omgjort til en rotasjonsbevegelse, ved å bruke et veiv og veivsystem, som kan drive hjulene til et lokomotiv eller rotoren til en elektrisk generator.
Nipper til drinker
Handlingen med å håpe en brus eller en juice av en flaske gjennom et plastrør er relatert til Boyle's lov. Når luften i røret foreslås ved bruk av munnen, er det en reduksjon i trykket inne i røret.
Dette trykkfallet letter den stigende bevegelsen av væsken i røret, og tillater inntak. Det samme prinsippet fungerer i blodutvinning ved å bruke en sprøyte.
Luftveiene
Boyle's Law er nært knyttet til luftveissystemets funksjon. I løpet av inspirasjonsfasen oppstår sammentrekningen av mellomgulvet og andre muskler; For eksempel eksterne interkostaler som produserer en utvidelse av ribbeholderen.
Dette forårsaker en reduksjon i intrapleuraltrykk, noe som forårsaker en lungeutvidelse som gir en økning i lungevolum. Derfor reduseres intrapulmonalt trykk i henhold til det som reises i Boyle's lov.
Ved å bli subatose det intrapulmonale trykket, strømmer atmosfærisk luft inn i lungene, som gir en økning i trykket i lungene; dermed samsvarer med trykket til atmosfæretrykk, og avslutter inspirasjonsfasen.
Deretter slapper inspirasjonsmuskler og ekspirasjonsmusklene trekker seg sammen. I tillegg produseres elastisk lungetrekk, et fenomen som gir en reduksjon i lungevolum, med en påfølgende økning i intrapulmonalt trykk, forklarbar etter Boyle's lov.
Ved å øke intrapulmonalt trykk, og bli større enn atmosfæretrykk, strømmer luft inn i lungene til atmosfæren. Dette skjer til presset er lik, noe som avslutter utløpsfasen.
Referanser
- Boyle's Law. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Formelen for Boyle's Law. Gjenopprettet fra: Thoughtco.com

