Halvparten av min hva er, grunnlag, forberedelse, bruker
- 1991
- 166
- Jonathan Moe
Han Min halvdel Det er en biokjemisk test som brukes til å hjelpe til med å identifisere arter av bakterier som tilhører Enterobacteriace -familien. Den er ganske næringsrik og er sammensatt av glukose, gjærekstrakt, pepton, triptein, l -ornitinhydroklorid, bromocresh og agar lilla.
Betydningen av dets forkortelse (min) beskriver hver av parametrene som kan observeres i dette mediet; Motilitet, indol og ornitin. Motilitet er mikroorganismens evne til å bevege seg rundt tilstedeværelsen av flagella. For at denne egenskapen skal observeres, må konsistensen av mediet være semi -solid, så forberedelsene har mindre mengde agar.
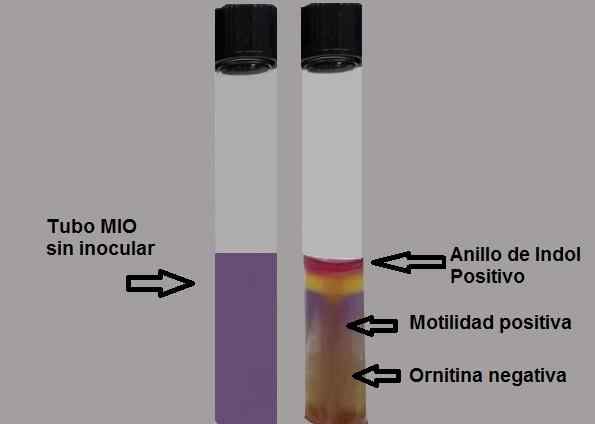
 Tolkningsplan for resultater i mediumgruven. Kilde: Utarbeidet av forfatter MSc. Marielsa Gil
Tolkningsplan for resultater i mediumgruven. Kilde: Utarbeidet av forfatter MSc. Marielsa Gil Indolproduksjon viser at tilstedeværelsen av enzymtriptofanasa som virker på tryptofanaminosyren, er nødvendig for å bruke et avslørende reagens for å synliggjøre produksjonen av indol.
Endelig avgjør ornitin om bakteriene er i stand til dekarboksillær.
Basis
Pepton, gjærekstrakt og triptein
Disse elementene bidrar til ernæringskraften til dette mediet. De fungerer som en kilde til essensielle næringsstoffer og aminosyrer for bakteriell utvikling.
I tillegg er Triptein en kilde til tryptofan for å demonstrere tilstedeværelsen av enzymtriptofanasa, som nedbryter tryptofan skyld.
Indol er fargeløs, derfor avsløres tilstedeværelsen ved å legge til fem dråper av Ehrlich eller Kovacs-reagens, begge med P-dimetylaminobenzaldehyd.
Aldehydgruppen av denne forbindelsen reagerer med Indol, og genererer et Fuchsia rød -formet produkt på overflaten av agaren.
Enhver farge av farger bør betraktes som en positiv test. Testen må leses umiddelbart, siden tiden fargen nedbryter.
På den annen side må denne testen avsløres etter å ha bemerket resultatene av bevegelighet og dekarboksylering av ornitin.
Kan tjene deg: kompakt bein: egenskaper, struktur, funksjonerTolkning
Positiv test: Dannelse av en fuchsia rød ring når du tilsetter Kovacs -reagensdråper.
Negativ test: Det er ingen ringdannelse.
Bevegelighet
Bakteriets kapasitet til å flytte vil være bevis.
En negativ motilitetstest vil bli bevist ved å observere en tynn vekstlinje, og alt rundt vil være uten vekst.
Det er viktig at bevegelighet blir lest før avsløring.
Hos mobile bakterier, men av langsom vekst er det vanskelig å demonstrere dens bevegelighet med dette mediet. I dette tilfellet anbefales det å bruke andre tester eller metoder, for eksempel middels bevegelighet eller den ventende slippmetoden.
Glukose
Glukose er gjærbart karbohydrat som i tillegg til å tilveiebringe energi, surifiserer mediet, en nødvendig tilstand slik at dekarboksyleringen av ornitinaminosyren kan oppstå.
Glukosefermentering bør alltid forekomme, basert på prinsippet om at alle bakterier som tilhører Enterobacteriaceae Family gjæring glukosen.
L -ornitin
I tilfelle bakteriene produserer enzymet ornitin dekarboksylase, kan det virke når mediet er blitt surgjort ved glukosefermentering.
Enzymet ornitin dekarboksylase virker på karboksylgruppen til aminosyren som produserer et amin kalt putresina som alkheies mediet igjen.
Denne testen skal leses etter 24 timers inkubasjon, for hvis du prøver å lese før du kan misforstå testen med en falsk negativ.
Husk at den første reaksjonen som oppstår er gjæringen av glukose, så mediet blir gult i en innledende fase (første 10 til 12 timer). Hvis dekarboksyleringen av ornitinet oppstår senere, vil mediet bli lilla.
Det er viktig å tolke dekarboksyleringstesten av ornitinet før du avslører indolen, siden aggregatet av KOVACS -reagenset modifiserer fargen på mediet.
Kan tjene deg: Naturens riker og dens egenskaperTolkning
Negativ test: gult eller gult medium.
Positiv test: helt lilla halvparten.
PH -indikator
I dette tilfellet brukes bromocresol lilla; Personen som har ansvar for å avsløre når det er en pH -endring i midten. Ved å forsurende blir indikatoren gul, og når alkalinarier blir lilla.
Sådd og avslørt teknikk
For å så mitt medium av meg, brukes en rett eller nål og en del av kolonien for å studere blir samlet med den.
En dyp punktering er laget i min midt i en rett linje. Det er ikke tilrådelig.
Inkuber i 24 til 48 timer ved 37 ° C ved aerobiose. Observer resultatene i denne rekkefølgen: bevegelighet, dekarboksylering av ornitinet og til slutt avsløre indolen.
Det anbefales å ta 2 ml til mediet, overføre det til et sterilt rør og utføre indol -testen der, så hvis det gir negativt, kan resten av det originale røret inkuberes i 24 timer mer, for å avsløre indolen igjen.
Utviklingen av indolen gjøres som følger: 3 til 5 dråper av Kovacs -reagenset tilsettes i My Miljø og omrørt sterkt. Det blir observert om en fuchsia rød ring dukker opp eller ikke.
Forberedelse
Min halvdel
Vei 31 gr av miljøet mitt og oppløs i en liter destillert vann.
Varm til blandingen koker et øyeblikk, og rør ofte til du løser opp agaren fullstendig. Fordel 4 ml av mediet i 13/100 testrør med bomullslokk.
Steriliser i autoklav ved 121 ° C i 15 minutter. Fjern fra autoklaven og la stå rett i et sjokk, slik at en semi -solid taco dannes.
Oppbevares i et kjøleskap på 2-8 ° C. La et temperament før såing av bakteriell belastning.
Fargen på det dehydrerte mediet er beige og den med medium tilberedt lilla litt opalescerende.
Det kan tjene deg: Divergent Evolution: Årsaker og eksemplerDen endelige pH for det forberedte mediet er 6,5 ± 0.2
Mediet blir gult med syre pH og er lilla til alkalisk pH.
Kovacs Reactive (Indol Test Developer)
Dette reagenset er fremstilt som følger:
150 ml amyl, isoamyl eller butylalkohol måles (noen av de tre). 10 gr p-dimethylaminobenzaldehyd oppløses i den. Deretter tilsettes 50 ml konsentrert saltsyre sakte tilsatt.
Det forberedte reagenset er fargeløs eller klar gul. Den må lagres i ravflaske og konserveres i kjøleskap. En mørkebrun farge viser sin forverring.
Også Kovacs -reagenset kan erstattes av Ehrlich Reagent. Sistnevnte, fordi den er mer følsom, foretrekkes å avsløre indol i bakterier som produserer den i minimale mengder, som i noen ikke -fermenterende negative baciller og visse anaerober.
Bruk
Dette mediet er en test som kompletterer et batteri med biokjemiske tester for identifisering av bakteriene som tilhører Enterobacteriace -familien.
Decarboxyleringdataene til ornitinet tjener til å differensiere Shigella Sonnei, Det gir positivt, av Shigella Boydii, Shigella Flexneri og S. Dysenterieae, De gir negativt.
Det skiller også slekten Klebsiella, som gir negativ, av Enterobacter -slekten, der de fleste av artene gir positive.
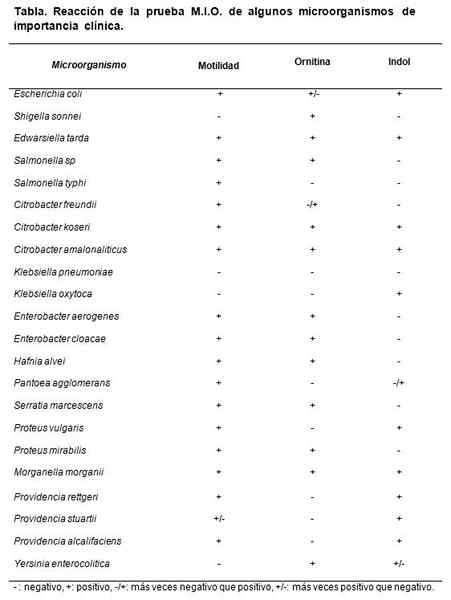 Kilde: Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Pan -American redaksjon S.TIL. Argentina.
Kilde: Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Pan -American redaksjon S.TIL. Argentina. QA
Hver gang en halv av meg er utarbeidet, kan en kontrolltest utføres. For dette brukes kjente eller sertifiserte stammer for å observere mediets oppførsel.
Stammene som kan brukes er Escherichia coli, Morganella Morganii, Klebsiella pneumoniae, Enterobacter aerogenes og Proteus mirabilis.
De forventede resultatene er OG. coli og m. Morganii. Dan M: +, I: + og O: +.
Klebsiella pneumoniae Gi alt negativt (M:-, I:-, O :-). Proteus mirabilis og Enterobacter aerogenes Dan M:+ I:- Og O: +.
Referanser
- Mac Faddin J. (2003). Biokjemiske tester for identifisering av bakterier for klinisk betydning. 3. utg. Pan -American redaksjon. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12 Ed. Pan -American redaksjon S.TIL. Argentina.

