Quiraral rankic blanding, eksempler
- 2366
- 530
- Prof. Theodor Gran
EN Racmic Mix o Racmatics er den sammensatt av to enantiomerer i like deler og er derfor optisk inaktiv. Denne optiske aktiviteten refererer til evnen til sine løsninger til å rotere, i en plan eller anti -foil, en stråle av polarisert lys som reiser gjennom dem i en retning.
En enantiomer har muligheten til å rotere det polariserte lyset, si til venstre (Levógiro), så den rene løsningen vil være optisk aktiv. Imidlertid, hvis dette begynner å legge enantiomeren som roterer lyset til høyre (dextrogyry), vil dens optiske aktivitet avta til det er inaktivert.
 Grueklynger, som deler et slektskap med rankiske blandinger utover etymologi. Kilde: Pexels.
Grueklynger, som deler et slektskap med rankiske blandinger utover etymologi. Kilde: Pexels. Når dette skjer, sies det at det er de samme mengdene av Levogiro og Dextrógiro enantiomerer; Hvis et molekyl ødelagt det polariserte lyset til venstre, vil effekten bli kansellert umiddelbart når det er "snubler" med et annet molekyl som roterer det til høyre. Og så videre. Derfor vil vi ha en rankisk blanding.
Den første forbedringssynet ble gjort av den franske kjemikeren Louis Pasteur i 1848, som studerte en blanding av enantiomere krystaller av tartarsyre (på den tiden kalt rankic acid). Når denne syren fra druene som ble brukt til vinproduksjon, endte denne blandingen på å bruke på en generell måte for alle molekyler.
[TOC]
Sko og chiralitet
For det første er det en resonnementblanding, det må være to enantiomerer (vanlige), noe som innebærer at begge molekyler er kiraler og at speilbildene deres ikke er overlappbare. Et par sko illustrerer dette perfekt: Uansett hvor mye venstre sko blir forsøkt til høyre, kan de aldri passe.
Kan tjene deg: svak syreDen høyre skoen, for å si, avleder det polariserte lyset til venstre; mens venstre sko gjør det til høyre. I en hypotetisk løsning der sko er molekylene, hvis det bare er rettighetssko, kiraler, vil dette være optisk aktivt. På samme måte vil det skje hvis det bare er igjen sko i løsningen.
Imidlertid, hvis det er tusen venstre sko blandet med tusen rettighetssko, er det da en rankisk blanding, som også er optisk inaktivt, siden avvikene som lyset har på innsiden av, kanselleres gjensidig.
Hvis de i stedet for sko var baller, gjenstander som er akvirale, ville det være umulig for dem å eksistere rangiske blandinger av disse, fordi de ikke engang ville være i stand til å eksistere som enantiomere par.
Eksempler
Vinsyre
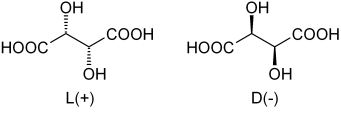 Tartarsyre -enantimerer. Kilde: Dschanz [Public Domain]
Tartarsyre -enantimerer. Kilde: Dschanz [Public Domain] Tilbake til tartarsyre var den rankiske blandingen den første som møtes. I det øvre bildet vises de to enantiomerer, hver i stand til å danne krystaller med morfologiske ansikter av "venstre" eller "høyre". Pasteur, ved å hjelpe et mikroskop og en streng innsats, klarte å skille disse enantiomere krystaller fra hverandre.
Krystallene til enantiomerer l (+) og d (-) hver for seg, presenterer optisk aktivitet ved å avlede det polariserte lyset til høyre eller venstre, henholdsvis. Hvis begge krystaller i de samme molar proporsjoner oppløses i vann, vil en optisk inaktiv rankisk blanding oppnås.
Merk at begge enantiomerer har to chirale karbonatomer (med fire forskjellige substituenter). I L (+) er OH bak flyet dannet av karbonskjelettet og COOH -gruppene; Mens i D (-) er disse oh over nevnte fly.
De som syntetiserer tartarsyre, vil oppnå en rankisk blanding. For å skille enantiomeren L (+) fra D (-), er en quiral oppløsning nødvendig, der denne blandingen reagerte med en chiral base for å produsere disteroisomersalter, i stand til å skille seg deretter ved fraksjonell krystallisering.
Kan tjene deg: Kobbersulfid: Struktur, egenskaper, bruksområderKinin
 Strukturelt skjelett av kininmolekylet. Kilde: Benjah-BMM27.
Strukturelt skjelett av kininmolekylet. Kilde: Benjah-BMM27. I forrige eksempel, for å referere til en rankisk blanding av vinsyre, er den vanligvis skrevet som syre (±) -tartarisk. I tilfelle av kinin (overlegen bilde) vil det være (±) -kvinina.
Isomeria av kininen er kompleks: den har fire chirale karbonatomer, noe som gir opphav til seksten diasteroisomerer. Interessant nok er to av dens enantiomerer (den ene med Oh over flyet og den andre under det) faktisk diasthelisomerer, siden de er forskjellige i konfigurasjonene til sine andre chirale karbonatomer (de av sykkelen med N -atomet til n).
Nå er det vanskelig å spesifisere hvilke av stereoisomerer i kininen som vil avlede det polariserte lyset til høyre eller til venstre.
Talidomide
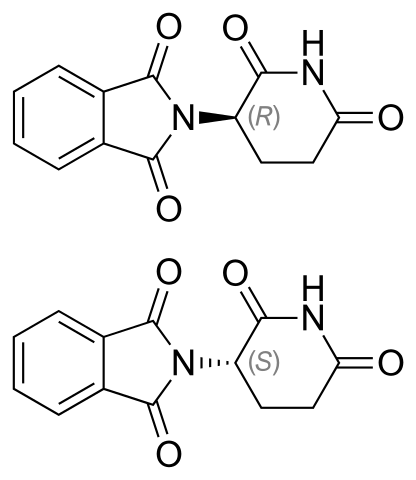 Talaidomide Enantimers. Kilde: Vaksinasjonsist [Public Domain]
Talaidomide Enantimers. Kilde: Vaksinasjonsist [Public Domain] Talidomide enantiomerer er vist ovenfor. Det har bare et quiralt karbon: den som er knyttet til nitrogen som blir med begge ringer (en av ftalimida og den andre av gluteramid).
I enantiomeren R (med beroligende egenskaper) er phtalimida -ringen (den til venstre) orientert over flyet; mens du er i enantiomer S (med mutagene egenskaper), nedenfor.
Prosenten av de to er ikke kjent, som av de to avleder lyset til venstre eller høyre. Det som er kjent, er at en blanding 1: 1 eller 50% av begge enantiomerer danner den rankiske blandingen (±) -Talidomid.
Hvis du bare vil markedsføre talidomidet som et hypnotisk beroligende middel, er det obligatorisk å sende inn sin rankiske blanding til den allerede nevnte chirale oppløsningen, slik at den rene enantiomeren oppnås.
Kan tjene deg: kvartære forbindelser: egenskaper, trening, eksempler1.2-epoksipropan
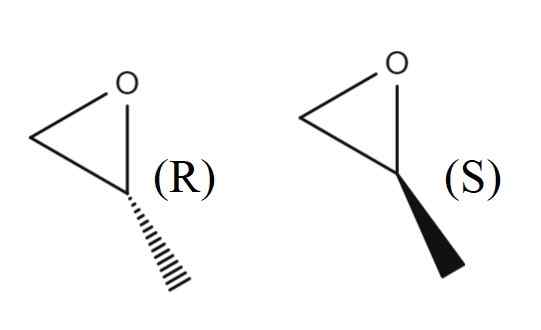 1,2-epoksipropan-enantiomerer. Kilde: Gabriel Bolívar.
1,2-epoksipropan-enantiomerer. Kilde: Gabriel Bolívar. I det øvre bildet har du paret av enantiomerer på 1,2-epoxipropano. Enantiomer r avleder det polariserte lyset til høyre, mens S avleder det til venstre; Det vil si at den første er (r)-(+)-1,2-epoksipropano, og den andre (er)-(-)-1,2-epoksipropano.
Den rankiske blandingen av dem to, igjen, i et forhold på 1: 1 eller 50%, blir (±) -1,2 -epoksipropan.
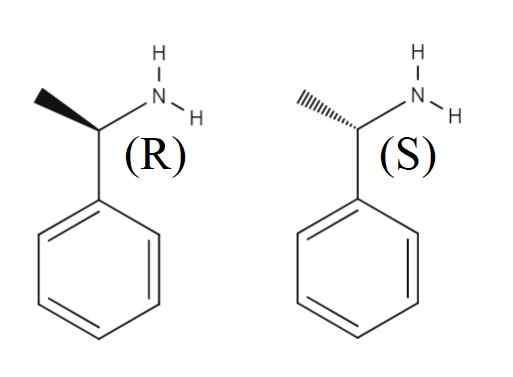
1-fenyletylamin
 Enantiomerer av 1-penyletylamin. Kilde: Gabriel Bolívar.
Enantiomerer av 1-penyletylamin. Kilde: Gabriel Bolívar. Øvre en annen rankisk blanding dannet av de to enantiomerer av 1-feniletylamin er vist. Enantiomer r er (r)-(+)-1-fenyletylamin, og enantiomer s (s)-(-)-1-feniletilamin; Den ene har metylgruppen, Cho3, peker utenfor det aromatiske ringplanet, og den andre peker under dette.
Legg merke til at når konfigurasjonen er R, sammenfaller den noen ganger med det faktum at Enantiómero roterer det polariserte lyset til høyre; Imidlertid gjelder det ikke alltid og kan ikke tas som hovedregel.
Endelig kommentar
Viktigere enn eksistensen eller ikke av rankiske blandinger er den chirale oppløsningen av den samme. Dette gjelder spesielt for forbindelser med farmakologiske effekter som er avhengig av slikt stereoisom; Det vil si at en enantiomer kan være gunstig for pasienten, mens den andre kan påvirke den.
Det er grunnen til at disse chirale oppløsningene blir benyttet til separate rankiske blandinger i komponentene sine, og dermed kunne markedsføre dem som rene medisiner fri for skadelige urenheter.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Steven a. Hardinger. (2017). Illustrert ordliste over organisk kjemi: racemisk blanding. Department of Chemistry & Biochemistry, UCLA. Gjenopprettet fra: Chem.UCLA.Edu
- Nancy Devino. (2019). Racemisk blanding: Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- James Ashenhurst. (2019). Stereokjemi og chiralitet: Hva er en racemisk blanding? Gjenopprettet fra: MasterorganicChemistry.com
- John c. Leffingwell. (2003). Chirality & bioactivity i.: Farmakologi. [PDF]. Gjenopprettet fra: Leffingwell.com

