Myofilamenter typer, struktur og organisering
- 2006
- 64
- Thomas Karlsen
De Myofilamenter De er de kontraktile proteiner av myofibriller, som er de strukturelle enhetene av muskelceller, langstrakte celler som kalles muskelfibre.
Muskelfibre og deres komponenter har spesielle navn. For eksempel er membran, cytoplasma, mitokondrier og endoplasmatisk retikulum kjent som sarkolem, sarkoplasma, sarkosomer og sarkoplasmatisk retikulum, henholdsvis.
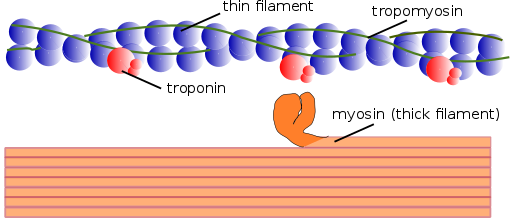
 Myofilaments Struktur (kilde: Mikael Häggström, brukt med permisjon. [Public Domain] via Wikimedia Commons)
Myofilaments Struktur (kilde: Mikael Häggström, brukt med permisjon. [Public Domain] via Wikimedia Commons) På samme måte kalles de kontraktile elementene inni myofibriller sammen; og de kontraktile proteiner som utgjør myofibriller kalles myofilamenter.
Det er to typer myofilamenter: tynne og tykkelser. Tynne filamenter består hovedsakelig av tre proteiner: actin F, tropomiosin og troponin. Tykke filamenter er i mellomtiden bare sammensatt av et annet protein kjent som Myosina II.
I tillegg til disse er det andre proteiner assosiert med både tykke og tynne filamenter, men disse har ikke kontraktile funksjoner, om ikke ganske strukturelle, blant dem for å nevne noen titine og nebulin.
[TOC]
Typer muskelfibre
Den spesielle disposisjonen av myofilamenter som utgjør myofibriller gir opphav til to typer muskelfibre: stripete muskelfibre og glatte muskelfibre.
Straced muskelfibre, når du undersøker et optisk mikroskop, viser et mønster av strierikk eller tverrgående bånd som gjentas langs hele overflaten og som gir navnet, til muskelen som inneholder dem, av stripet muskel. Det er to typer stripete muskelfibre, skjelett og hjerte.
Muskelfibre som ikke viser at mønster av kryssbånd kalles glatte fibre. Det er de som utgjør muskulaturen til vaskulære vegger og viscera.
Struktur
Tynne myofilamenter
Disse myofilamentene er sammensatt av aktin F og to tilknyttede proteiner: tropomiosin og troponin, som har reguleringsfunksjoner.
Aktin F, eller filamentøs aktin er en polymer fra et annet mindre kuleprotein som kalles actin G eller kuleforløp, med omtrent 42 kDa molekylvekt. Den har et fagforeningssted for myosin, og blir beordret til å danne to kjeder arrangert som en dobbel propell komponert omtrent 13 monomer per sving.
Det kan tjene deg: Proteolyse: Typer og funksjonerAktin F -filamenter er preget av å ha to poler: en positiv, rettet mot skive Z, og en annen negativ, arrangert mot sentrum av sarcomero.
Tropomiosin består også av en dobbel dobbel propellpolypeptidkjede. Det er et 64 kDa -protein som danner filamenter som er lokalisert i furene som er igjen av de doble propellkjedene til de tynne filamentene i aktin F, for eksempel "å fylle" de tomme plassene i propellen.
I ro dekker tropomiosin eller "lokk" unionsstedene for actin for myosin, og forhindrer interaksjonen mellom begge proteiner, og det er det som forårsaker muskelsammentrekning. Rundt hvert tynt glødetråd og ca. 25 eller 30ηm fra begynnelsen av hvert tropomiosin er et annet protein kalt troponin.
Troponin (TN) er et proteinkompleks sammensatt av tre underenheter av kulepolypeptider kalt troponin T, C og I. Hvert tropomiosinmolekyl har et tilhørende troponinkompleks som regulerer det, og sammen er de ansvarlige for reguleringen av begynnelsen og fullføringen av muskelsammentrekning.
Tykke myofilamenter
Tykke filamenter er myosin II -polymerer, som veier 510 kDa og dannes av to tunge kjeder på 222 kDa hver og fire lette kjeder. Lette kjeder er av to typer: essensielle lette kjeder, 18 kDa og regulatoriske lette kjeder på 22 kDa.
Hver tunge kjede av Myosina II har formen som en stokk med et lite kulehode i enden som er projisert nesten 90⁰ og har to fikseringssteder, ett for aktin og en for ATP. Dette er grunnen til at disse proteinene tilhører Atasas -familien.
Et tykt glødetråd består av mer enn 200 myosin II -molekyler. Det kulehodet til hvert av disse molekylene fungerer som en "roing" under sammentrekningen, og skyver aktinen som den er koblet sammen slik at den glir mot midten av sarkomeren.
Organisasjon
I en skjelettmuskelfiber okkuperer myofibriller det meste av sarkoplasma, og er ordnet i langsgående og bestilte sett i hele cellen.
Kan tjene deg: mitokondrierI et langsgående snitt sett med et optisk mikroskop, blir lysbånd, kalt Bands I, og Dark Bands, kalt Bands A Bands observert. Disse båndene tilsvarer den ordnede disposisjonen av myofibrils, og derfor av myofilamentene som komponerer dem.
I midten av bandet er jeg en mørk og tynn linje som heter linje eller plate z. Senteret for hvert bånd A presenterer et tydeligere område kjent som Band H, som er sentralt delt på en mørkere linje kalt M -linje.
Avgrenset mellom to z -linjer, er en struktur som kalles sarkomer beskrevet, som er den funksjonelle enheten til skjelettmuskelen. En sarkomer er sammensatt av kontraktile myofilamenter arrangert i band A, H og et hemi-band I i hver ende.
Bånd Jeg inneholder bare tynne filamenter, båndet inneholder tykke filamenter sammenvevd i de to ender med fine filamenter og båndet H bare inneholder tykke filamenter.
Hvordan er myofilamenter organisert innen sarkomer?
Både tykke myofilamenter og tynne myofilamenter kan observeres når du undersøker en skjelettmuskelprøve ved elektronisk mikroskop. Det sies at disse som er "interdign" eller "intertwine" med hverandre i en sekvensiell, ryddig og parallell disposisjon.
De tynne filamentene stammer fra Z -skivene og strekker seg til hver side i motsatt retning og mot midten av hver tilstøtende sarkomere. Fra Z -platene i hver ende av sarcomero, i den avslappede muskelen, når aktinen begynnelsen av båndet H på hver side.
I muskelfibrene i skjelettmuskelen avslappet tykke myofilamenter det sentrale området som danner de mørke båndene eller båndene a; Og de tynne filamentene strekker seg på begge sider av sarkomeren uten å nå midten av den.
I et kryss -seksjon i regionen der de tykke og tynne filamentene overlapper hverandre, kan et sekskantet mønster observeres som inkluderer det tykke glødetråden i midten og seks tynne filamenter som omgir det, og som er lokalisert i hver av sekskant kanten av sekskant.
Kan tjene deg: Simplasto: Deler og egenskaperDenne organisasjonen av myofilamenter i sarkomeren er bevart av funksjonen til en serie protein assosiert med myofilamenter og som har strukturelle funksjoner, blant dem Titine, alfa -aktinet, nebulinet, miomesinet og proteinet C kan fremheves.
Sammentrekningsmekanisme
Når acetylkolin (en nevrotransmitter) frigjøres i den nevromuskulære platen på grunn av stimulering av en motorisk nevron, er muskelfiberen begeistret og spenningsavhengige kalsiumkanaler til sarkoplasmatiske retikulos åpnes.
Kalsium binder seg til troponin C, og dette genererer en konformasjonsendring i tropomiosin, som utsetter aktive steder, og dermed starter sammentrekningen. Når kalsiumnivåene faller, går tropomiosin tilbake til sin startposisjon og sammentrekningen opphører.
Eksponeringen av unionsstedene til aktinet med myosin lar begge proteiner bli sammen med, og at myosin skyver aktinet mot sentrum av sarkomeren, og glir over myosin.
Under muskelsammentrekning nærmer z -linjene til hver sarkomer sentrum, nærmer seg linje M, øker interdigitering mellom aktin og myosin og reduserer størrelsen på bånd I og H. Graden av forkortelse vil avhenge av summen av forkortelsen av hver av sarkomerne av den inngåtte muskelen.
Referanser
- Berne, r., & LEVY, M. (1990). Fysiologi. Mosby; Internasjonal utgave.
- Fox, s. Yo. (2006). Menneskelig fysiologi (9. utg.). New York, USA: McGraw-Hill Press.
- Gartner, l., & Hiatt, j. (2002). Histology Atlas Text (2. utg.). Mexico d.F.: McGraw-Hill Inter-American Editors.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Harpers illustrerte biokjemi (28. utg.). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biokjemi. Burlington, Massachusetts: Neil Patterson Publisher.
- Ross, m., & Pawlina, w. (2006). Histologi. En tekst og atlas med korrelert celle- og molekylærbiologi (5. utg.). Lippinott Williams & Wilkins.
- West, J. (1998). Fysiologisk grunnlag for medisinsk praksis (12ava ed.). Mexico d.F.: Pan -American Medical Editorial.
- « Promielocito -egenskaper, funksjoner og patologier
- Sjiraffegenskaper, habitat, reproduksjon, mat »

