Myosinegenskaper, struktur, typer og funksjon
- 3087
- 562
- Anders Mathisen
De Myosin Det er en molekylær motor, av protein natur, i stand til å bevege seg på aktinfilamenter i cytosol. Energien som driver forskyvningen av myosin kommer fra ATP -hydrolyse. På grunn av dette er myosin vanligvis definert som et mecanokjemi -enzym.
I eukaryoter er myosin et veldig rik protein. Det er forskjellige typer myosin, som er kodet av en familie av gener. I gjær skilles 5 klasser, mens dusinvis er blitt beskrevet hos pattedyr.
 Kilde: David Richfield (Bruker: Slashme) Når du bruker dette bildet i eksterne verk, kan det siteres som følger: Richfield, David (2014). "Medical Gallery of David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]
Kilde: David Richfield (Bruker: Slashme) Når du bruker dette bildet i eksterne verk, kan det siteres som følger: Richfield, David (2014). "Medical Gallery of David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]] Myosin har et bredt utvalg av funksjoner. Myosin I, ved siden av aktin, deltar i bevegelsen av keratocytter.
Myosin II gir stivhet til plasmamembranen, deltar i cytokinesis og muskelsammentrekning. Begge, myosinas I og II, samarbeider med cellemigrasjon. Myosinas I og V utfører transport av vesikler langs aktinfilamenter.
[TOC]
Struktur
I elektroniske mikrografer har den typiske myosinisoformstrukturen tre domener: hode, nakke og hale. Gjennom hydrolyse med chimotripsin, oppnås et segment bestående av hode og nakke, kalt tung meromiosin (HMM) og et halesegment, kalt lys meromiosin (LMM).
Mestring av hodet er den N-terminale enden av den tunge kjeden, og halen til halen er den C-terminale enden av den lette kjeden.
Myosinklasser kan differensieres av antall polypeptiske kjeder som komponerer det, og overflod og lettkjedeklasse forenet rundt.
Myosin I har en polypeptidkjede, som danner et hode og halen mangler alfa -helikudiske regioner. Mens myosinas I og V har to polypeptidkjeder, og der.
Myosinas I og V har fagforeningssteder til Calmodulin, som regulerer og fikser CA+2, I lette kjeder. Myosina jeg fikset CA+2 I lette kjeder, men det gjør det annerledes enn calmodulin.
Kjennetegn
På det mekaniske nivået har myosinas tre egenskaper, nemlig:
- Myosinsjefen er det motoriske domenet som avanserer ved diskrete trinn: foreningen av myosin leder til et aktinfilament, dets tilbøyelighet og påfølgende separasjon gir bevegelse av myosin. Denne prosessen er syklisk og avhenger av ATP.
- Konformasjonsendringer: Hydrolyse av et ATP -molekyl er koblet på hvert trinn i et myosinmolekyl, ved hjelp av amplifiserings- og overføringsnivåer. Dette innebærer store konformasjonsendringer av myosin.
Kan tjene deg: radial symmetriDet første forsterkningsnivået produseres ved tap av gamma-fosfatgruppen til ATP, som tillater en omorganisering av strukturelle elementer på ATP Union-nettstedet. Denne omorganiseringen er koordinert med strukturelle endringer på unionsstedet til aktin.
Det andre forsterkningsnivået innebærer kommunikasjon av konformasjonsendring i det aktive stedet til strukturelle komponenter i terminalkarboksen.
- Retning: Det har blitt funnet at min har en polaritet, eller omvendt retning, mot slutten (+) av aktinfilamentet. Denne konklusjonen kommer fra utjevningseksperimentene til aktinfilamentet, ved bruk av fluorescens optisk mikroskop.
Funksjoner
Myosin, ved siden av aktin, deltar i muskelsammentrekning, cellulær vedheft, cytokinesis, gir stivhet til kortikale membraner og forskyvning av noen vesikler, blant andre funksjoner.
Myosindefekter kan produsere patologiske forhold. For eksempel er feil i myosinas I og V relatert til henholdsvis myopatier fra myosin- og pigmentforstyrrelser (Griselli syndrom). Mens lidelsene i myosinisoforms VI forårsaker tap av øret.
Muskelsammentrekning
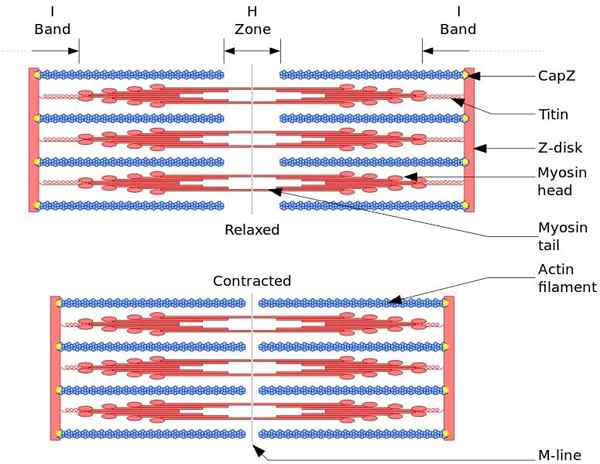
Den funksjonelle og strukturelle enheten til skjelettmuskel er sarkomro. Under muskelsammentrekning når lengden på sarkomeren 30% av den opprinnelige lengden.
Sarcomeres består av tykke, myosin og tynne filamenter av aktin, som er organisert på en kompleks måte. Generelt sett er myosinhoder plassert i de distale ender av glødetråden og halene mot midten av sarkomeren, og organisasjonen er bipolar.
For å lage muskelsammentrekning, må myosinhoder, av de motsatte ender, bevege seg til Z -platen eller enden (+) av glødetråden. Fordi organiseringen av tykke filamenter er bipolar, oppstår glidning av tynne filamenter på tykke filamenter, drevet av ATP.
Forskyvningskraften oppstår fordi hundrevis av myosinhoder, av et tykt glødetråd, samhandler med et tynt glødetråd.
Cytocinesis
Under mitosen, når mikrotubuli av spindelpolene er separert, danner aktin og myosin II en kontraktil ring i cellen til cellen. Denne ringen trekker seg sammen sin diameter og deler cellen i to deler.
Gi stivhet til kortikale membraner
I mutante celler som mangler myosin II, er plasmamembranen lett deformer når en ytre kraft blir brukt. Dette skjer fordi myosin II gir aggregeringskraft til plasmamembranproteinene.
Kan tjene deg: morfologisk tilpasningCellulær vedheft
I epitelvevet er den kontraktile aktin- og myosin II -bjelkene lokalisert i nabolagene til plasmamembranen, og danner et sirkulært belte som omgir den cellulære celleoverflaten. Dette sirkulære beltet bestemmer formen på cellen og opprettholder foreningen mellom cellene.
Kontakten mellom celler skjer av den sirkulære belteforeningen til celleadhesjonsmolekyler ved bruk av bindende proteiner.
Forskyvning av noen vesikler
Eksperimentelle bevis avslører at myosin V utfører membrantransport fra Golgi -apparatet til periferien av cellen. Noen bevis er:
- I nervøse vevsceller, ved immunofluorescens av astrocytter, ble det funnet at myosin V ligger ved siden av Golgi.
- I gjær avbryter mutasjoner i myosin V -gen proteinsekresjon, og følgelig akkumuleres proteiner i cytosol.
- Myosin I -isoformer har ansvaret for å transportere vakuolas til cellemembranen. Ved å bruke spesifikke antistoffer mot myosin I -isoformer, ble det funnet at disse isoformene er lokalisert i forskjellige deler av cellen.
For eksempel, når en levende amøbe er merket med et antistoff mot myosin IC, blir transporten av vakuolen til membranen arrestert. På grunn av dette utvides vakuolen og cellen eksploderer.
Myosin -relaterte sykdommer
Myosinas og tap av øre
Det er mange gener og mutasjoner som gir tap av øre. Denne sykdommen er ofte monogenetisk .
Mutasjoner i ukonvensjonelle myosinas, med ett eller to hoder av myosin, påvirker funksjonen til det indre øret. Noen av de muterte myosin -isaformene er myosin IIIA, Myosin VIIA og Myosin XVA. Nylig ble to mutasjoner oppdaget i myosin VI.
Mutasjonene i myosin VI er C.897g> T og P.926Q. Den første mutasjonen påvirker et område som samhandler med den aktive lokaliseringen, kalt bryter I. Homozygot for mutasjon tidlig viser fenotypen, og forårsaker alvorlige effekter.
Den andre mutasjonen påvirker et område med belastning med belastning, i en alfa -propell i halen til myosin VI. Denne regionen er viktig for den proksimale dimeriseringen av motoren, og påvirker stereokartfunksjonen til myosin VI.
Det kan tjene deg: Auxiliary Sciences of BiologyEn annen mutasjon er P.Asn207Ser, som produserer en motor som ikke kan produsere styrke. Dette er fordi ASN 207 er en aminosyrerest av det aktive stedet, hvis funksjon er unionen og hydrolyse av ATP.
Mutasjonen p.ARG657TRP produserer tapet av myosin VI -funksjon. ARG -resten er involvert i konformasjonsendringene som fester hydrolyse til myosinbevegelse.
Myosin X og kreft
Myosina X (MYO10) er et ukonvensjonelt myosin som kommer til uttrykk i hjernen, endotelios og mange epitel. MYO10 og tre typer aktinbaserte anslag (filopoder, fakturer og anslag som ligner på filopodianere) fungerer under kreftmetastase.
Invasive kreftceller har et stort antall filopoder og uttrykker høye nivåer av fascin. Dette proteinet utfører kryss mellom aktinfilamenter. For å unnslippe fra den primære svulsten, dannes invaddies, rik på proteolytisk aktivitet, som fordøyer den omkringliggende ekstracellulære matrisen.
Når cellene når den ekstracellulære matrisen, hjelper anslagene som ligner på filopoder til å spre og kolonisere. Høye nivåer av MYO10 indikerer høy aggressivitet og metastase i brystkreft.
Myoxs lyddemping gir tap av den metastatiske karakteren til celler, som ikke er i stand til å danne aktinbaserte anslag. Alle disse anslagene har forståelsesbaserte vedheft, som transporteres med MY1010 i filopodiet.
Myox er involvert i dannelsen av sentrene. Fraværet av Myox favoriserer dannelsen av multipolare pigger. Myox er også involvert i signalering i kreftceller. For eksempel aktiveres Myox av 3,4,5, -inositol trifosfat (PIP3).
Referanser
- Alberts, f., Johnson, a., Lewis, J., og kål. 2007. Biologi av cellemolekylæren. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, a., Karfunkel-Don, d., Sirigu, s., DAVIDO, f., Shohat, m., FRYDMAN, m., Houdusse, a., Kanaan, m., Avraham, k. 2014. Nye myosinmutasjoner for arvelig hørselstap blir avslørt av målrettet genomisk fangst og massivt parallell sekvensering. European Journal of Human Genetics, 22: 768 -775.
- Courson, d.S. og Cheney, R.OG. 2015. Myosin-X og sykdom. Eksperimentell celleforskning, 334: 10-15.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, p., Baltimore, d., Darnell, J. 2003. Cellulær og molekylær biologi. Redaksjonell Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Schliwa, m. og woehlke, g. 2003. Molekylære motorer. Natur, 422: 759 - 765.
- Til verdt.D. 2003. Den molekylære verktøykassen for intacellulær transport. Cell, 112: 467-480.
- « Exonuklease -egenskaper, struktur og funksjoner
- Bromhistorie, struktur, elektronisk konfigurasjon, egenskaper, bruk »

